ОПИСАНИЕ:
Тип MICROSPORIDIA Balbiani, 1882 — МИКРОСПОРИДИИ
Высокоспециализированные одноклеточные ами- тохондриальные эукариоты, паразитирующие в клетках животных всех систематических типов. Преспорогональные стадии представлены амебоидными клетками, которые размножаются бинарным или множественным делением. В процессе спорогонии образуют сложно устроенные одноклеточные споры со свойственным только микроспоридиям аппаратом экструзии комплексом органелл, осуществляющих выброс полярной трубки и зародыша из споры и проведение зародыша по каналу трубки непосредственно в клетку хозяина. Размножение большинства микроспоридий происходит бесполым путем. Половой процесс типа гаметоцитогамии описан у нескольких полиморфных диксенных микроспоридий, образующих 3 типа спор и паразитирующих в двукрылых насекомых и ракообразных.ИСТОРИЯ ИЗУЧЕНИЯ
История изучения микроспоридий насчитывает более полутора веков. В 1838 г. Глюге (Gluge, 1838) описал микроспоридий как организмы неизвестной природы, вызывающие у рыб образование ксеном. В последующие сорок лет публиковались сообщения об их находках у нематод (Bischoff, 1855) и у членистоногих, в основном у насекомых (Leidig, 1858; Pasteur, 1870). Однако природа и систематическое положение микроспоридий определены не были.В 1882 г. Бальбиани опубликовал работу о принадлежности микроспоридий к споровикам Sporozoa. Впоследствии это положение было опровергнуто, но в ту эпоху стало шагом вперед, так как после признания микроспоридий одноклеточными организмами их исследование приняло более целенаправленный характер. Уже на ранних этапах изучения микроспоридий было выяснено огромное отрицательное значение этих паразитов в таких отраслях хозяйственной деятельности человека, как шелководство и пчеловодство.
Наиболее продолжительный и продуктивный этап светомикроскопических исследований микроспоридий длился с 1883 по 1960 г. Предположение Бальбиани о родстве микроспоридий с миксоспоридиями (также ошибочное) поддержал Телоан (Thelohan, 1895), первым обнаруживший у спор микроспоридий полярные нити. Из-за несовершенства оптики многие артефакты («швы» на оболочке спор вследствие фиксации, ложная многоядерность) трактовались в пользу родства этих двух групп паразитов. Много внимания уделялось жизненным циклам микроспоридий: были описаны мерогония и спорогония, показано, что у полиспоровых видов весь спорогональный плазмодий в отличие от миксоспоридий превращается в споры.
В конце XIX в. Лаббе (Labbe, 1899) включает микроспоридий вместе с актиномиксидиями, миксоспориднями и саркоспоридиями в один класс Cnidosporidia. В свете современных данных интересно его предположение о возможной принадлежности микроспоридий к дрожжевым грибам. Лаббе первым, суммируя опубликованные данные, приводит в списке 3 рода и более 35 видов микроспоридий. Через 10 лет число видов возрастет вдвое (Auerbach, 1910). Система в пределах отряда микроспоридий, учитывающая особенности спорогонии и морфологию спор, наиболее полно представлена в монографии Кудо (Kudo, 1924). С небольшими модификациями она не теряла своего значения почти 50 лет. В эти же годы впервые были показаны одноклеточный характер спор и наличие у них только одного или двух ядер, а не нескольких, как это считалось ранее (Jirovec, 1936).
С 1959 г. началось интенсивное изучение стадий жизненного цикла микроспоридий и патологии инва- зированной клетки животного-хозяина методами электронной микроскопии. Был выявлен уникальный план тонкого строения спор, и показана обособленность микроспоридий от других групп одноклеточных эукариотов. В результате ранг микроспоридий был поднят от отряда до типа (Sprague, 1977; Weiser, 1977). Впервые были описаны диксенные жизненные циклы с развитием микроспоридий в двух хозяевах, образование одним видом двух и даже трех типов спор, половой процесс (Pilley, 1976; Sweney et al., 1985, 1988). Большое разнообразие тонкого строения клеток стадий спорогонии и спор, жизненных циклов микроспоридий значительно расширило круг таксономических признаков, сделав возможным описание новых форм, что привело к увеличению числа родов в 10 раз, а видов — почти в 5 раз (преимущество получили монотипичные роды).
В 60-е гг. в России также началось изучение микроспоридий, паразитирующих в насекомых сельскохозяйственного, медицинского и ветеринарного значения, а также в рыбах и многих гидробионтах, служащих кормовой базой рыб (Исси, 1986; Воронин, 1986, 1999).
На основании особенностей тонкой организации клеток стадий спорогонии, в первую очередь спор (Исси, 1986) и жизненных циклов, в частности наличия полового процесса (Sprague et al., 1992; Воронин, 2001), были предложены новые системы типа Микроспоридии. Однако следует признать, что все современные системы носят временный (утилитарный) характер. По единодушному мнению микроспоридиологов, действительный объем видов микроспоридий будет многократно превышать объем уже описанных форм и, следовательно, при новых описаниях будут выявляться и использоваться новые таксономические критерии. Поэтому в современном, последнем по времени издания определителе простейших характеристики родов микроспоридий приведены по алфавиту без указания их принадлежности к таксонам более высокого ранга (Canning, Vavra, 2000).
В 80-е гг. прошлого столетия началось изучение физиологии микроспоридий и процессов метаболизма в клетках паразитов и их хозяев в целях выявления механизмов патогенности. Для определения степени родства между отдельными группами микроспоридий или между микроспоридиями и другими организмами начали использовать биохимические и молекулярно-биологические методы. Обобщающей исследования этих лет стала монография «The Microsporidia and Microsporidiosis» (Wittner, Weiss, 1999), состоящая из обзорных статей микроспоридиологов, работающих в разных странах, включая Россию. В книгу вошли работы по молекулярной биологии и филогении микроспоридий, по их биохимии и физиологии (Weiss, Vossbrinck, 1999 (Weidner et al., 1999). Состояние исследований конца XX в. по микроспоридиям насекомых отражено в обзоре Соколовой и Исси (2001). Использование молекулярной биологии при изучении филогенетических взаимоотношений микроспоридий приводит к построению систем, значительно отличающихся от систем, созданных на основе морфологических критериев. В то же время новые методы подтвердили высказанные ранее предположения о разном происхождении некоторых морфологически близких форм, как это происходит сейчас с видами сборного рода Nosema. Эти перспективные направления микроспоридиологии подошли к этапу интенсивного развития в наступившем новом веке. Основная проблема, которую необходимо решить для построения новой системы микроспоридий, наиболее достоверно отражающей филогенетические связи входящих в этот тип форм, — это совмещение данных, полученных биохимическими и молекулярно-биологическими методами и методом морфологического анализа.
Последний этап изучения микроспоридий как паразитических одноклеточных эукариотов, адаптированных к развитию в клетках билатеральных животных всех систематических типов (с единственным пока известным случаем заражения животного с лучевой симметрией — пресноводной гидры), поставил перед исследователями вопросы о месте микроспоридий в системе живых организмов, о времени их происхождения и о их родственных связях с другими организмами. На основании наличия у микроспоридий хитина в оболочке спор, сходства последовательностей альфа- и бета-тубулинов, а также у половины известных форм — диплокариотического ядерного аппарата, что свойственно грибам, Кавалье-Смит (Cavalier-Smith, 1998) сделал заключение о происхождении микроспоридий от грибов. Однако при этом современные данные не позволяют однозначно судить о том, представляют ли собой микроспоридии потомков митохондриальных одноклеточных грибов (близких дрожжевым), сильно редуцированных вследствие перехода к внутриклеточному паразитизму, или же их сходство с грибами может быть объяснено происхождением от общей предковой формы. Исходя из этого Карпов (2000) поместил микроспоридий в основание филогенетического древа, давшего начало грибам.
Японские исследователи (Hashimoto, Nasegawa, 1996), изучавшие филогенетические взаимоотношения амитохондриальных протистов путем анализа аминокислотных последовательностей трансляционных факторов элонгации (EF-la и EF-2) и синтеза изолейцил- и валил-ТРНК (ileRS и valRS) синтетаз, пришли к выводу, что все исследованные ими группы представляют собой рано оформившиеся ветви эукариотных организмов, причем к самой древней группе они отнесли микроспоридий. Чуть позже у микроспоридий выделили митохондриальный хит-шо- ковый белок hsp70, что свидетельствует в пользу утери ими митохондрий и вторичности их амитохондриаль- ного статуса (Germot et al., 1997). Однако даже данные о возможном происхождении микроспоридий от грибов не опровергают мнения о том, что микроспоридии — древнейшие из эукариотных паразитов, сохранившие примитивные признаки, не связанные с редукцией вследствие паразитизма.
ОБЩИЕ ПРЕДСТАВЛЕНИЯ О МИКРОСПОРИДИЯХ
Микроспоридии (Microsporidia) — одноклеточные эукариоты, паразитирующие в клетках животных почти всех систематических типов. Им свойственны своеобразные черты организации, сочетающей эукариот- ные и прокариотные признаки. Их споры содержат уникальный комплекс органелл, известный только для микроспоридий, — аппарат экструзии, который предназначен для заражения клетки хозяина путем прокола ее оболочки и вбрасывания зародыша непосредственно в цитоплазму. Функционально спора микроспоридий превращена в живой шприц. Механический способ переноса зародыша из споры в клетку животного-хозяина также неизвестен для других протистов и, будучи примитивным, говорит о древности этих организмов. (Аналогичным способом попадают в клетку бактерий наиболее примитивные вирусы — бактериофаги, а также простейшие, паразитирующие в клетках водорослей или высших растений).Микроспоридии имеют морфологически оформленное ядро, но их геном — наименьший из известных для других эукариот (он даже меньше генома некоторых бактерий), а митоз носит форму закрытого внутриядерного плевромитоза.
У микроспоридий нет митохондрий, гидрогеносом и пероксисом, но наличие митохондриального шаперона — хит-шокового белка hsp70 — свидетельствует об утере ими митохондрий в процессе адаптации к облигатному внутриклеточному паразитизму. Аппарат Гольджи примитивного типа. Рибосомы зародыша микроспоридий, спороплазмы, представлены монорибосомами, не агрегированными в полирибосомы, и по своим физическим (коэффициенту седиментации), биохимическим и молекулярно-биологическим (последовательности участков рРНК, устанавливаемой сиквенированием) показателям соответствуют рибосомам прокариотов по наличию субъединицы 70S и по слиянию субъединицы 5.8S, свойственной эукариотам, с большой субъединицей рРНК (Ishihara, Hayashi, 1968; VossbrincK, Woese, 1986). Кроме того, клетка микроспоридий лишена лизосом, центриолей, запасных питательных веществ, жгутиков и других органелл движения. Наличие хитина, альфа- и бета-ту- булинов, сходных с грибными (Hirt et al., 1997), дипло- кариотический ядерный аппарат некоторых микроспоридий, а также молекулярно-биологические характеристики дали возможность предположить родство этих протистов с дрожжевыми грибами. Но не существует ни одного современного таксона царства Fungi, к которому можно отнести микроспоридий. Давний переход микроспоридий к паразитическому образу жизни, глубокая адаптация к внутриклеточному паразитизму, обусловленные этим изменения в геноме и в обменных процессах, ультраструктурная перестройка их клетки, по нашему мнению, рано увели микроспоридий в сторону от основного направления эволюции эукариотных одноклеточных и многоклеточных организмов. Свободноживущие предки микроспоридий, которые могли быть общими с грибами или с водорослями, не известны.
О раннем переходе микроспоридий к паразитизму свидетельствует их широкое распространение среди животных всех систематических групп, от других простейших до высших позвоночных, включая человека. К настоящему времени описано более 140 родов и 1200 видов микроспоридий, преобладающее число видов паразитирует у членистоногих, в основном у насекомых и ракообразных, у некоторых из них выявлено несколько видов паразитов разных родов. Например, у личинок хирономуса Chironomus plumosus (Diptera), частого объекта лабораторных исследований, описано около 10 видов микроспоридий. Наиболее многочисленны и разнообразны микроспоридии у гетеротопных насекомых, сменяющих водный образ жизни на наземный, — у кровососущих комаров Culicidae, комаров-звонцов Chironomidae и мошек Simuliidae. Бурное видообразование хозяев привело к не менее бурному видообразованию паразитов. Предполагается, что полный объем видов микроспоридий будет превосходить объемы видов насекомых и ракообразных взятых вместе, достигнув нескольких миллионов. Поэтому один из крупнейших микроспоридиологов XX в. Виктор Спрэг (Sprague, 1977) назвал микроспоридий объектом исследований XXI в.
МОРФОЛОГИЯ И УЛЬТРАТОНКОЕ СТРОЕНИЕ СТАДИЙ ЖИЗНЕННОГО ЦИКЛА.
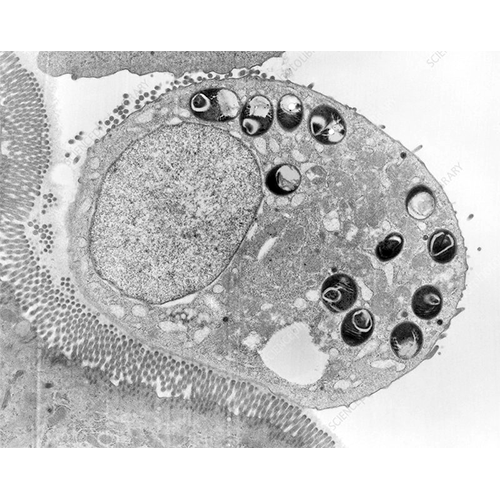
Микроспоридии проходят развитие внутри клетки животного-хозяина. Абсолютное большинство видов локализуется в цитоплазме, в более редких случаях — в ядре клетки, или в перинуклеарном пространстве (между двух мембран), или в углублении ядра. Заражение клетки происходит путем механического прокола ее оболочки полярной трубкой, выстреливаемой с большой силой из споры, и ввода по ее каналу зародыша микроспоридий — спороплазмы непосредственно внутрь клетки. Вне организма хозяина микроспоридии могут выжить какое-то время, только достигнув стадии зрелой споры.В процессе развития микроспоридии проходят стадии спороплазмы, меронтов первой и второй мерого- нии (преспорогональная часть цикла), споронта, споробласта и споры (спорогональная часть цикла). При светооптических исследованиях все внутриклеточные преспорогональные стадии представлены амебоидными клетками с одним, несколькими или многими ядрами. Электронно-микроскопические исследования также выявили чрезвычайную простоту строения пре- спорогональных стадий и сложное строение спор, особенности которого широко используются в систематике микроспоридий.
Спороплазма — инвазионная стадия, представлена одиночным ядром (или диплокарионом), окруженным тонким слоем цитоплазмы с монорибосомами. При нахождении в споре она не имеет собственной оболочки и по каналу выброшенной из споры полярной трубки «протискивается» ядро (диплокарион) паразита. Можно сказать, что в клетку хозяина вбрасывается геном микроспоридий. Но в клетке хозяина спороплазма уже окружена собственной плазматической мембраной толщиной около 7 нм, происхождение которой составляет предмет дискуссии. Размеры этой кратковременной стадии не превышают 0.5—1.0 мкм. Через несколько часов спороплазма увеличивается в размерах, в ее цитоплазме появляется шероховатая эндоплазматическая сеть (ШЭР) — она превращается в меронт, пролиферативную стадию жизненного цикла микроспоридий.
Меронт представляет собой округлую клетку с одиночным или парным ядром, которая интенсивно растет и размножается. После нескольких ядерных делений образуются двух- или многоядерные формы. Многоядерный плазмодий имеет либо сферическую форму и ядра, расположенные по всему объему цитоплазмы, либо лентовидную — с расположением ядер в один-два ряда по всей его длине, либо форму «розетки» (ромашки) с ядрами, расположенными по периферии в выступах плазмодия. После периода роста многоядерные клетки делятся, вновь образуя клетки с одиночным или парным ядром. У многих видов, особенно при бинарном делении клеток, меро- гония повторяется. Размножение происходит до полного заселения всей цитоплазмы клетки хозяина.
Плазматическая мембрана клетки меронта у большинства микроспоридий гладкая. Но в цитоплазме клетки хозяина вокруг меронта часто видны трубчатые структуры или мелкие вакуоли — свидетели интенсивных обменных процессов и секреторной деятельности паразитов. Цитоплазма меронтов содержит гладкую и шероховатую эндоплазматическую сеть, рибосомы и примитивный, состоящий из тонких трубчатых структур аппарат Гольджи. Другие органеллы в клетках меронтов микроспоридий не обнаружены.
У наиболее примитивных микроспоридий сем. Met- chnikovellidae, паразитирующих в грегаринах, меро- гония либо отсутствует, либо очень кратковременна. У высокоорганизованных форм микроспоридий описаны 2 последовательные мерогонии, которые завершаются образованием мерозоитов. При световой микроскопии меронты первой мерогонии имеют мелкие, ярко окрашивающиеся ядра, клетки второй мерогонии отличаются от них крупными (после фиксации угловатыми) и слабо окрашиваемыми ядрами и сильно развитой ШЭР, представленной многочисленными каналами и цистернами. Закончив период пролиферации, микроспоридии приступают к спорогонии.
Ядра микроспоридий — самые мелкие среди эукариот. Меронты имеют от одного до нескольких одинаковых ядер либо одиночного, либо парного расположения. Одиночные ядра (монокарионы) сферические, реже овальные или бобовидные, их диаметр варьирует у разных видов в пределах 1—3 мкм, достигая самых маленьких величин (0.5—2 мкм) в споре. Ядра диплокариона имеют форму двух полусфер, образующих при контакте единую сферу. В зоне контакта ядер ядерные поры отсутствуют. Меронты первой и второй мерогонии могут различаться по организации ядерного аппарата.
Строение ядерного аппарата по одиночному или диплокариотическому типу — важный таксономический признак, отличающий монокариотические и дип- локариотические формы микроспоридий. На протяжении всего развития 40 % родов микроспоридий имеют одиночные ядра, 14 — диплокарионы, у 46 % родов происходит перестройка ядерного аппарата.
Клетки микроспоридий лишены центриолей. Центры организации микротрубочек митотического веретена представлены у них центриолярными пластинками, сходными с таковыми дрожжевых грибов. Это электронноплотные диски на внешней и внутренней сторонах ядерной оболочки. В цитоплазме клетки, в непосредственной близости от пластинок, расположены 3—6 мелких пузырьков, ограниченных мембраной — NAO (nucleus associated organelles), функция которых неизвестна. Нуклеоплазма обычно гомогенна, ядрышки четко видны при переходе к спорогонии.
Деление ядер микроспоридий происходит по типу закрытого внутриядерного плевромитоза, с сохранением ядерной мембраны и внутриядерным расположением веретена деления. Оба ядра диплокариона делятся синхронно. Синаптонемальные комплексы, свидетельствующие о наличии редукционного деления и обнаруженные менее чем у половины родов микроспоридий, выявлены при преобразовании диплокариотических мерозоитов в монокариотические стадии спорогонии. Они представлены 2—3 электронноплотными пластинками около 100 нм ширины. Полйкомплекс обнаружен только у одного вида. В то же время у микроспоридий, на всем протяжении развития имеющих либо монокариотический (Encephalitozoori), либо диплокариотический (Nosema) ядерный аппарат, мейоз не выявлен и ген-маркер мейоза не обнаружен (Logsdon et al., 1997).
В ядрах микроспоридий содержится небольшое число слабоконденсированных хромосом, от 8 до 18, в зависимости от вида.
Геном микроспоридий — самый маленький для эукариотов, его размеры находятся в пределах 2.3 — 19.5 м. п. н. Так, для паразита человека Encephalitozo- оп intestinalis он равен 2.3 м. п. н. (Peyretaillade et al., 1998), а для паразита сверчка Paranosema grylli — 3.5 м. п. н. (Насонова и др., 1998). В то же время минимальный размер генома эукариотной клетки — 20 м. п. н., а размеры геномов бактерий находятся в пределах 0.8—9.2 м. п. н. (Trewors, 1996).
В результате секвенирования генома Е. cuniculi (Katinka et al., 2001) выявлены общий размер, равный 2.9 м. п. н., наличие 11 хромосом и 1997 белок-кодиру- ющих генов и отмечена тенденция к компактизации, свойственная большинству внутриклеточных паразитов. На основе изучения последовательностей ДНК в 11 хромосомах зависимость микроспоридий от клетки хозяина проиллюстрирована потерей генов в большинстве биосинтетических процессов. Многие муль- тикопийные гены представлены одной или ограниченным числом копий. Также показано, что у Е. cuniculi отсутствуют тандемные повторы генов рибосомальных РНК, и на каждой хромосоме выявлено только по две копии гена рРНК. Очень интересен факт выявления у микроспоридий гена обратной транскриптазы, говорящий о возможности микроспоридий либо ассимилировать гены своих хозяев, либо встраиваться в их геном (Weidner et al., 1999). Кроме того, гены микроспоридий, гомологичные генам других организмов, значительно короче. В геноме микроспоридий практически отсутствуют интроны и имеется ген, кодирующий хитин-синтетазу, свойственную дрожжевым грибам.
Споронт представляет собой начальную стадию спорогонии. Его морфологическое отличие от предшествующих стадий заключается в появлении вокруг клетки паразита второй наружной мембраны, выявляемой только при электронном микроскопировании. Обычно она возникает в виде электронноплотного материала, откладываемого на мембране меронта. Отдельные участки этого материала постепенно смыкаются и плотным слоем покрывают мембрану меронта. Этот слой может быть гладким, как у Neoperezia chironomi, или покрытым рядами гранул, как у Anncaliia meligethi. Для спо- ронта характерно интенсивное функционирование аппарата Гольджи, играющего основную роль в процессах спорогенеза, главным образом, в продуцировании многочисленных мембранных образований в цитоплазме клетки паразитов и в формировании аппарата экструзии.
Споронты — единственная стадия спорогонии, способная к размножению. (Крайне редко споронты дают 2 поколения клеток). Ядро споронта претерпевает от одного до многих делений. В результате деления двухъ- или многоядерных спорогональных плазмодиев образуются споробласты. Число ядерных делений споронта и количество образующихся споробластов, затем спор служат одними из важнейших таксономических критериев рода.
У многих микроспоридий в период спорогонии снаружи от оболочки споронта (чаще многоядерного) закладывается еще одна, образующая оболочку спорофорного пузырька (по старой терминологии — панспоробласта). Оболочка спорофорного пузырька постепенно отдаляется от оболочки спорогонального плазмодия, между ними возникает полость, в которой завершает свое развитие поколение клеток, образовавшихся из споронта.
Оболочки спорофорных пузырьков у разных родов микроспоридий закладываются на разных этапах развития и имеют достаточно сложное строение. По времени закладки оболочки делятся на меронтогенети- ческие и споронтогенетические. У микроспоридий родов Pleistophora и Vavraia они окружают паразитов уже на стадии мерогонии (Canning, Hazard, 1982), но у абсолютного большинства видов их появление совпадает с началом спорогонии. В этом случае наружная оболочка споронта образует серию мелких или крупных пузырьков (блистеров), иногда трубчатых структур, направленных в цитоплазму клетки хозяина. Мембрана этих образований постепенно смыкается и либо отделяется от оболочки споронта, образуя полость пузырька, либо остается плотно прижатой к споронту до выхода спор паразита во внешнюю среду.
У микроспоридий Holobispora thermocyclopis дополнительная оболочка образуется на стадии споробласта, а ее отслоение происходит после созревания спор при их попадании в воду. Такую оболочку можно назвать споробластогенетической. Эти три типа оболочек различаются не только по времени образования, но и функционально: первые два регулируют отношения между клетками паразита и хозяина, третий — между клеткой паразита и внешней средой. Сами оболочки бывают однослойными или состоят из нескольких слоев, имеющих мембраноидное, мембранное, трубчатое или нитчатое строение.
Для многих микроспоридий характерна сферическая форма спорофорных пузырьков. У паразитов водных насекомых пузырьки могут быть оснащены придатками в виде длинных нитей (Trichoduboscqia), или остаются соединенными между собой (Pegmatheca, Parapleistophora), или сильно разбухают в воде, образуя слизистые сферы (Neoperezia). Вероятно, при этом повышается плавучесть спор (удельный вес спор микроспоридий больше такового воды) или они лучше удерживаются на водных растениях, что удлиняет сроки возможных контактов паразита с новым хозяином.
Полость спорофорных пузырьков либо абсолютно прозрачна, либо заполнена трубчатыми структурами или гранулами секрета, форма и размеры которых характерны для каждого вида микроспоридий. Иногда секрет представлен плотными скоплениями материала, образующего тельца почти такого же размера, как споробласты паразита {Tabanis- pora bacillifera). Эти признаки также имеют таксономическое значение.
Споробласт образуется в результате деления споронта и представляет собой переходную стадию от этой морфологически просто устроенной клетки к имеющей сложную организацию споре. Именно на этой стадии происходит морфогенез органелл, свойственных споре. Основная роль в морфогенезе аппарата экструзии принадлежит аппарату Гольджи.
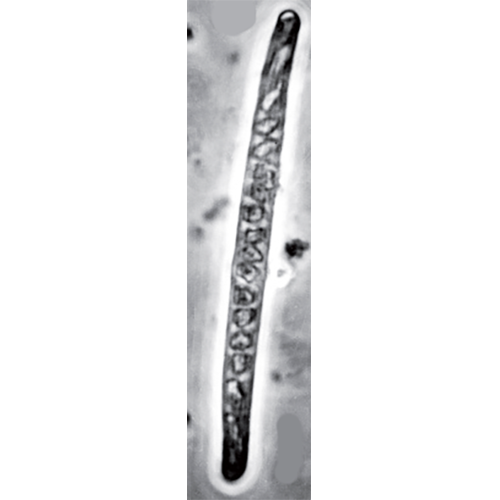
Аппарат Гольджи микроспоридий представлен скоплениями тонких трубчатых структур, ограниченных гладкой мембраной и соединенных с эндоплазматической сетью (Sokolova et al., 2001). На стадии меронтов трубчатые структуры аппарата Гольджи не заполнены секретом и представляют собой примитивный цис-Гольджи, участвующий в образовании внешней оболочки споронта (Canning, Nicholas, 1980). В начале формирования аппарата экструзии сеть трубочек заполняется секретом и достигает значительных размеров, занимая иногда до трети объема клетки споробласта. В этот момент аппарат Гольджи имеет вид рыхлой сферы. Витки полярной трубки, образующиеся внутри этой сферы, в «готовом виде» поступают в цитоплазму клетки паразита. Таким образом, не вызывает сомнений, что основная роль аппарата Гольджи состоит в формировании аппарата экструзии (Vavra, 1976в). Одновременно с образованием полярной трубки к переднему полюсу будущей споры от ядра мигрирует зачаток полярного якорного диска, представленный электронноплотным материалом, заключенным в вакуоль. Достигнув полюса, он принимает форму гриба или арбалета. В процессе дальнейшего спорогенеза базальный прямой участок полярной трубки своим основанием прикрепляется к якорному диску, лежащему под наиболее тонким участком оболочки споры, и соединяется со спиральными витками трубки, расположенными под оболочкой в задней половине споры. Основание полярной трубки проходит по центру плотно уложенных мембран, образующих поляропласт. Поляропласт отделен от оболочки споры полярным саком, в виде зонтика прикрывающим эту структуру. По окончании формирования аппарата экструзии образуются споры. Спора — завершающая стадия в развитии микроспоридий. Ее функции — сохранение (обычно кратковременное) инвазионного начала во внешней среде и заражение новой особи хозяина. Споры микроспоридий, несмотря на очень мелкие размеры, представляют собой сложно организованную клетку. Обязательными компонентами спор микроспоридий любого уровня организации являются зародыш, аппарат экструзии (примитивный или сложный) и оболочка, состоящая у большинства видов из трех слоев.
Форма спор у большинства видов овальная, реже грушевидная, почковидная, кеглевидная, шаровидная или палочковидная. Размеры спор преимущественно укладываются в пределы от 2.5 до 5.5 мкм в длину и от 1.5 до 2.5 мкм в ширину. Исключением служат очень мелкие или очень длинные споры. Так, например, диаметр сферических спор Enterocytozoon bieneusi около 1 мкм, а длина спор Bacillidium filiferum достигает 40 мкм. С учетом их размеров споры микроспоридий лежат в пределах 1—40 мкм в длину и 0.2—5.4 мкм в ширину. В отличие от дрожжей, размеры клеток которых сильно различаются, споры микроспоридий одного вида имеют близкие размеры. Спора микроспоридий — единственная стадия, способная выжить какое-то время вне организма хозяина. Однако ее трудно назвать покоящейся стадией, так как она всегда готова к заражению восприимчивого хозяина.
Зародыш (спороплазма), расположенный в центре споры между поляропластом и задней вакуолью, защищен с боков витками полярной трубки, лежащими в один или два слоя. Он представлен одиночным ядром или диплокарионом, окруженным узкой зоной обезвоженной цитоплазмы. В этой зоне тесно к ядру прилегают 2—6 рядов спирально расположенных рибосом с коэффициентом седиментации 70S, с субъединицами 50S и 30S. На стадии споры ядро имеет наименьшие размеры, обычно не превышающие 1—2 мкм. Собственной цитоплазматической мембраны у зародыша нет.
Аппарат экструзии состоит из полярной трубки (ПТ) (ее наличие обязательно для всех представителей типа), поляропласта, якорного диска, полярного сака и задней вакуоли. Якорный диск имеет форму шляпки гриба, арбалета, реже сферы (Canningia) и расположен на переднем полюсе споры. К нему прикреплено основание ПТ, проходящей через центр поляропласта. В световом микроскопе у живых спор поляропласт виден как передняя вакуоль, занимающая от 1/4 до 1/2 объема споры. По данным электронной микроскопии, поляропласт большинства видов представлен «кипой» плотно уложенных мембран, образованных стенками сплющенных пузырьков. Пластины ориентированы перпендикулярно длинной оси споры. Кроме пластинчатого поляропласта описаны геликоидальный и везикулярный (из крупных или мелких камер), а также гранулярный, трубчатый или из концентрических сфер . Поляропласт часто состоит из двух или трех участков, обычно передний образован плотно уложенными мембранами, в то время как задний может быть из рыхлых мембран, или из везикул, или из трубочек. У высокоорганизованных микроспоридий поляропласт сконцентрирован у переднего полюса споры, у более примитивных форм сем. Chytridiopsidae и у видов рода Thelohania он полностью или частично расположен по длине ПТ, у самых примитивных микроспоридий представлен несколькими вакуолями.
Поляропласту приписывают две функции. Во-первых, создание высокого внутриспорового давления (до 30—60 атм.), необходимого для выворачивания «наизнанку» и выброса ПТ. Предполагается, что высокое давление создает процесс, сходный с надуванием воздушных шариков, — когда под влиянием внешнего импульса мембраны сплющенных пузырьков раздвигаются и резко увеличивают свой объем, превращаясь в вакуоли (Lom, Vavra, 1963). Во-вторых, участие в удлинении ПТ путем «надставки» ее мембранами поляропласта (Weidner, 1972).
Самая характерная органелла микроспоридий — ПТ различно устроена при нахождении внутри споры и после выброса из нее. Внутри споры — это длинная структура, ограниченная двумя мембранами и заполненная по оси веществом умеренной электронной плотности. После выброса из споры и выворачивания наизнанку трубка становится полой. Длина выброшенной ПТ колеблется от 2 до 400 мкм (у большинства видов лежит в пределах 20—60 мкм), т. е. может в десятки раз превосходить длину споры, а иногда и собственную длину при нахождении в споре.
От якорного диска, к которому прикреплено ее основание, ПТ идет назад и, не доходя до ядра, поворачивает к боковой стенке, ложась спиральными витками вокруг зародыша и в задней трети споры. Число спиральных витков уменьшается по мере созревания споры, и в зрелой споре большинства видов постоянно, служа надежным таксономическим признаком. Преимущественно число витков колеблется в пределах 6—12, но у некоторых форм достигает 30—36. Витки очень длинной ПТ лежат не в. один, а в два-три слоя. Каждому виду также свойственен свой угол наклона передних витков к длинной оси споры, который варьирует в пределах 30—90°. Однако имеются виды микроспоридий, у которых длина ПТ не превышает или незначительно превышает длину самой споры. Это представители примитивных микроспоридий сем. Metchnikovellidae, а также виды отряда Chytridio- psida и сем. Cylindrosporidae.
По особенностям своего строения ПТ разделены на несколько типов. У большинства видов ее диаметр по всей длине почти одинаков — это и з о - филярная трубка. У видов сем. Amblyosporidae диаметр первых витков значительно превышает диаметр последних с резким переходом от одного диаметра к другому — это анизофилярная трубка. Незначительная разница в диаметрах передних и последних витков ПТ характеризует слабоанизофилярные трубки. В сем. Mrazekidae толстый прямой участок трубки — манубрий переходит в тонкий, образующий витки, хлыст. У микроспоридий из водных членистоногих описаны трубки, у которых при близком по всей длине диаметре серии передних и задних витков различаются внутренним строением, а один виток на границе между ними отличается от всех остальных — это гетерофилярные трубки (Воронин, 1989). У примитивных форм трубка имеет форму ма- нубрия. У видов сем. Chytridiopsidae короткая толстая трубка покрыта снаружи структурой, похожей на пчелиные соты, вероятно камерами примитивного поляропласта.
Стенка трубки состоит из двух мембран: наружной, двухслойной, и внутренней из спирально лежащих фибрилл. Ось трубки заполнена гликопротеинами, при выворачивании трубки образующими вокруг нее дополнительный футляр. Возможно, что гликопротеины содержат вещества, подавляющие защитные реакции клеток хозяина (Weidner, 1972).
Задняя вакуоль образована одной или несколькими камерами, ограничена оболочкой, имеет разные размеры у разных видов, иногда в ее полости лежит постеро- сома — рудимент аппарата Гольджи. В спорах некоторых видов задней вакуоли нет.
Трехслойная оболочка споры состоит из экзоспоры, эндоспоры иплазматической мембраны. Экзоспора образована гранулами гликопротеинов, реже представлена мембранами. У некоторых родов (Atfvenia, Episeptum, Napamichum, Trichotuzetia) экзоспора многослойная, у других (Caudospora') образует выросты. Благодаря наличию выростов, придатков или слизистых капсул форма спор достигает большого разнообразия. Особенно характерны придатки для спор микроспоридий, паразитирующих у водных и гетеротопных насекомых. Их роль такая же, как у придатков спорофорных пузырьков. Удельный вес спор микроспоридий значительно больше удельного веса воды, а различные придатки или слизистые капсулы способствуют увеличению объема и плавучести спор или их задержанию в биотопе насекомого, повышая надежность встречи с новыми особями хозяина. Разрастания экзоспоры ведут к появлению таких эписпоровых образований, как «хвосты» и «плавники» (Caudospora, Jirovecia, Hrabeyia), гребни и ребра (Amblyospora, Golbergia, Weiseria), пучки длинных фибрилл на переднем и заднем полюсах (Cristulospo- rd), или на заднем полюсе и по «экватору» (Hirsutosporos), или только на заднем полюсе (Trichoctosporea), или с одного бока вблизи заднего полюса (Larssoniel- la), или же появляются одиночные фибриллы по всей поверхности (Ringueletium). У других микроспоридий две споры остаются соединенными вместе межспоровой перемычкой (Gurleyides, Issia, Norlevinea) или сферой, намного превышающей размеры спор (Se- пота). Трубчатые эписпоровые выросты, заметные только при электронном микроскопировании, известны для Ameson и Anncaliia.
Под экзоспорой лежит электронно-прозрачная эндоспора. Она достигает 0.4 мкм толщины и состоит в основном из хитина, устойчивого ко многим ферментам. На переднем полюсе споры, восприимчивом к внешним стимулам, ее слой более тонок и образуется позже, чем по остальному объему споры. Эндоспору следует рассматривать как одну из составляющих комплекса органелл аппарата экструзии. Наличие толстой эндоспоры делает возможным поддержание высокого внутриспорового давления, инициирующего экструзию ПТ и зародыша. Действительно, виды микроспоридий, споры которых имеют тонкую эндоспору или лишены ее вообще, как правило, отличаются короткими полярными трубками и слабо развитым поляропластом.
Вследствие различий в толщине разных участков экзоспоры и эндоспоры фиксация вызывает деформацию спор, характерную для рода или вида. Особенно сильно изменяется форма спор микроспоридий, паразитирующих на водных насекомых. Самый внутренний слой оболочки спор — цитоплазматическая мембрана, заключающая зародыш вместе со всеми органеллами аппарата экструзии.
Большинство родов микроспоридий — мономорфные формы, им свойственна одна спорогония и образование спор одного типа. 36 родов (около 20 %) микроспоридий, паразитирующих на высших насекомых — двукрылых (роды Amblyospora и Parathelohania), чешуекрылых (род Vairimorpha) и перепончатокрылых (род Burenella) — диморфные или полиморфные формы с двумя или тремя типами спорогонии и образованием двух или трех типов спор. Третий тип спор образуется в том же самом или в дополнительном хозяине — циклопе.
РАЗМНОЖЕНИЕ МИКРОСПОРИДИЙ.
Основной тип размножения, свойственный микроспоридиям, — это бесполое размножение на всем протяжении их жизненного цикла, за исключением завершающего этапа. Половой процесс описан у видов двух полиморфных родов микроспоридий.Бесполое размножение микроспоридий происходит на этапах мерогонии и в начале спорогонии либо бинарным делением клетки, которое следует сразу же за делением ядра на два дочерних, либо множественным делением многоядерного плазмодия. Множественное деление происходит различным, характерным для каждого вида, образом. При шизогонии ядра мигрируют на периферию плазмодия, выпячивая оболочку с участком цитоплазмы и образуя перед делением розетковидную форму (розетковидное деление). В отличие от классического почкования в этом делении участвует вся цитоплазма материнской клетки. При плазмотомии вокруг ядер, расположенных по всему объему плазмодия, обособляются участки цитоплазмы. Плазмотомия бывает единовременной или поэтапной. В первом случае плазмодий сразу делится на число клеток, соответствующее числу ядер или диплокарионов. Во втором — плазмодий постепенно делится на части со все меньшим числом ядер. Вакуолетомия (вакуоляция) описана для Nolleriapulicis (Beard et al., 1990). Она характеризуется тем, что в центре плазмодия образуется вакуоль, которая, распространяясь к периферии плазмодия, постепенно отделяет участки цитоплазмы с ядрами друг от друга (Vavra, Larsson, 1999). Для микроспоридий, интенсивно размножающихся во время мерогонии, характерно образование из одного споронта 1-—4 спор, а для видов, процессы мерогонии которых дают небольшое число особей, свойственна полиспоробластическая спорогония. Половой процесс у микроспоридий описан по статичным картинам, полученным по данным световой и электронной микроскопии видов со сложными циклами развития. Впервые кариогамия и мейоз установлены для микроспоридий рода Amblyospora на этапе перехода от мерогонии к спорогонии (Hazard, Brookbank, 1984). В дальнейшем для нескольких видов этого рода показано на_этапе мерогонии, проходящей в гемоцитах личинок насекомых, образование овальных клеток с папиллой, сосочком на одном полюсе (или грушевидных клеток), которые рассматриваются в настоящее время как гаметы. В результате попарного слияния цитоплазмы таких одноядерных клеток (плазмогамии) и тесного сближения их ядер образуется диплокариотическая клетка. На следующих этапах развития насекомых происходит, завершая половой процесс, слияние ядер диплокариона. Эта форма полового процесса названа гаметоцитогамией (Vavra, Larsson, 1999).
ФИЗИОЛОГИЯ И БИОХИМИЯ МИКРОСПОРИДИЙ.
При пероральной передаче паразитов экструзия ПТ и зародышей микроспоридий из спор происходит под воздействием пищеварительных ферментов хозина. Факторы, инициирующие этот процесс при трансовариальной, трансплацентарной или перкутанной передачах, еще не изучены. Однако известно, что гонотрофический цикл у самок двукрылых насекомых (слепней и комаров) — регулируемое гормонами созревание партии яиц после каждого кровососания — провоцирует также экструзию спороплазм у части спор микроспоридий, развившихся в эпителии яичников. В экспериментальных условиях экструзию можно вызвать самыми разными реагентами. Сам процесс экструзии до сих пор остается слабо изученным, предполагается, что он представляет собой крайне специализированную модификацию процесса экзоцитоза.Микроспоридии как облигатные внутриклеточные паразиты относятся к анаэробам. Утеряв в процессе адаптации к внутриклеточному паразитизму собственные митохондрии, микроспоридии с первых же минут своего развития нуждаются в экзогенной АТФ, продуцируемой митохондриями хозяина, став, таким образом, паразитами на энергетических системах инвазированной клетки. Показано наличие у микроспоридий переносчиков, обеспечивающих транспорт АТФ хозяина в клетку паразита (Katinka et al., 2001). Усиление энергетического обмена зараженной клетки сопровождается повышением концентрации фосфогексоз, АТФ, соотношения АТФ/АДФ и снижением содержания энергетических резервов (гликогена и триглицеридов) (Долгих, 1997, 2002; Weidner et al., 1999).
Ярким свидетельством «бурных» взаимоотношений микроспоридий с клеткой хозяина служит наличие вокруг пролиферативных стадий паразитов многочисленных филаментов или трубочек различного диаметра (а иногда и выростов цитоплазматической мембраны), синтезируемых клеткой паразита. По данным иммунологии, они представляют собой промежуточные филаменты класса кератинов, аналогичных кератинам млекопитающих. В конце развития микроспоридий все эти структуры исчезают, а на их месте в цитоплазме клеток хозяина образуются «пустоты» — участки минимальной электронной плотности.
Во внешней среде споры вынуждены поддерживать обмен самостоятельно. В качестве энергетического резерва микроспоридии используют дисахарид трегалозу. Высокая концентрация трегалозы служит, с одной стороны, энергетическим резервом (Долгих, Семенов, 2003), а с другой — создает осмотическое давление, необходимое для экструзии ПТ. Споры, завершающие развитие микроспоридий, не представляют собой покоящиеся стадии, поскольку для них характерен высокий уровень метаболической активности ферментов, в частности ферментов гликолиза (Долгих и др., 1997). Однако конечные продукты анаэробного катаболизма трегалозы у микроспоридий остаются до настоящего времени неизвестными.
ЖИЗНЕННЫЕ ЦИКЛЫ.
Заражение микроспоридиями обычно происходит при попадании спор в пищеварительный тракт животного-хозяина, где воздействие ферментов приводит к активации спор и экструзии ПТ и зародышей. Экструзия по своей быстроте сравнима с выстрелом и включает восприятие спорой импульса, создание высокого внутриспорового давления, эвагинацию (выворачивание) ПТ и проталкивание по ее каналу спороплазмы. ПТ обладает определенной жесткостью и пробивает стенку клетки хозяина (или клеток, если это происходит при заражении мелких членистоногих), вводя в нее спороплазму. Заражение клетки хозяина осуществляется механически, путем перфорации клеточной мембраны, что не известно для других протистов, паразитирующих в животных (Weidner, 1976). Большинство микроспоридий локализуется в цитоплазме клеток, но несколько видов развивается в ядре или в перинуклеарном пространстве. Спороплазмы, не попавшие в клетку, погибают.Развитие микроспоридий начинается с момента проникновения зародыша в клетку определенной ткани восприимчивого животного-хозяина. Обычно развитие от спороплазмы до споры происходит в пределах одной клетки или же клетки и ее потомства в том случае, когда пролиферативные стадии паразитов при делении зараженной клетки распределяются между дочерними клетками, создавая очаг инвазии. У позвоночных животных в распространении паразитов участвуют защитные клетки крови, которые транспортируют споры или спороплазмы по кровяному руслу. Оседая на восприимчивых тканях, они создают первичные очаги инвазии в непосредственной близости от кровеносных сосудов.
Спороплазма растет и превращается в меронт — пролиферативную стадию, которая размножается бинарным или множественным делением до тех пор, пока это позволяет энергетика зараженной клетки хозяина. По завершении мерогонии паразиты приступают к спорогонии. Споронт у большинства микроспоридий — последняя стадия жизненного цикла, способная к размножению. Как редкое исключение, известное только для рода Glugea, было описано дополнительное бинарное деление споробластов (sporoblast mother cells) (Canning et al., 1982b). В одной из последних работ (Canning, Vavra, 2000) такое дополнительное деление на этапе спорогонии описывается и у микроспоридии Pleistosporidium, но теперь эти стадии названы первыми (материнскими) и вторыми (дочерними) споронтами. Обычно ядра споронтов делятся от одного до нескольких раз. Образовавшиеся спорого- нальные плазмодии имеют лентовидную, розетковидную или сферическую форму. Значительно реже из одного споронта образуются один споробласт и одна спора. Стадии спорогонии развиваются либо в прямом контакте с цитоплазмой клетки хозяина, либо в полости спорофорного пузырька. Иногда стадии на всем протяжении развития или на каком-то его этапе отделяются от остального объема клетки хозяина ее структурами, образующими паразитофорную вакуоль. Все эти особенности спорогонии и число спор, образовавшихся из одного споронта, служат важными таксономическими признаками. Такова «синтетическая» схема жизненного цикла микроспоридий.
В то же время, по современным данным, жизненные циклы микроспоридий при соблюдении этой общей схемы чрезвычайно разнообразны и только по ядерным циклам могут быть разбиты на 5 основных групп. Почти у 80 % родов развитие заканчивается одной спорогонией с образованием одного типа спор. При этом из них 40 % на всем протяжении развития имеют монокариотический ядерный аппарат, 14 — диплокариотический, а у 25 % родов на определенных этапах развития один тип ядерного аппарата сменяется другим. В отличие от этих форм около 20 % родов имеют 2 или 3 типа спорогонии, образуя 2 или 3 типа спор, различающихся морфологически и функционально. При наличии 2 спорогоний все стадии одной из них представлены диплокариотическими формами, а у стадий другой спорогонии происходит чередование типов ядерного аппарата. В случае трех спорогоний цикл дополняется спорогонией, все стадии которой имеют монокариотический ядерный аппарат.
Среди микроспоридий с одиночными ядрами на всем протяжении развития описаны 8 родов, паразитирующих у других протистов — грегарин, миксоспори- дий и инфузорий, 2 рода из олигохет и по 1 из трематод и щетинохвосток (первично бескрылых насекомых). Многие представители этой группы относятся к семействам Metchnikovellidae и Chytridiopsidae и характеризуются примитивными аппаратами экструзии. Но в эту же группу входят и микроспоридии сем. Pleis- tophoridae с хорошо развитым аппаратом экструзии. У большинства родов мейоз отрицается.
Жизненные циклы монокариотических форм микроспоридий наиболее разнообразны. Здесь есть формы, которые развиваются в прямом контакте с цитоплазмой клетки хозяина или в паразитофорной вакуоли, окруженные шероховатым эндоплазматическим ретикулумом клетки хозяина или оболочкой спорофорного пузырька самого паразита: формы с лентовидными, розетковидными, сферическими спорогона- льными плазмодиями или без них и заканчивающие развитие образованием одной, нескольких или многих спор из одного споронта. Различные сочетания особенностей каждого этапа развития образуют не менее 10 типов жизненных циклов. Наиболее характерны из них три.
Жизненный цикл Metchnikovella hovassei, паразитирующей в грегарине Lecudina sp., характеризуется короткой (одним поколением клеток?) мерогонией (одно время она вообще отрицалась) и развитием стадий спорогонии без прямого контакта с цитоплазмой клетки хозяина. В мерогонии образуются клетки с 1—2 ядрами. Спорогония двух типов: либо в тонкостенных пузырьках (вероятно, паразитофорных вакуолях), либо в толстостенных удлиненных «цистах», спорофорных пузырьках. Материал умеренной электронной плотности откладывается на оболочке спорогонального плазмодия, формируя стенку «цисты». Споронт делится плазмотомией. Обе спорогонии образуют морфологически одинаковые споры. В каждом пузырьке развивается не менее 8 спор, слегка сплюснутых с полюсов, с ПТ в виде короткого манубрия и с очень тонкими эндо- и экзоспорой. Споры, развившиеся в паразитофорной вакуоли, предназначеныдля дальнейшего заражения той же особи хозяина, а споры из цист — для заражения новых особей.
Все стадии микроспоридии Nosemoides vivieri, также паразитирующей в грегарине Lecudina linei, развиваются в прямом контакте с цитоплазмой клетки хозяина. Стадии мерогонии одноядерные, их деление не описано. Многоядерный розетковидный спорогональный плазмодий дает начало спорам с хорошо развитым аппаратом экструзии.
Значительно усложняется цикл микроспоридий, паразитирующих в многоклеточных хозяевах. На всем протяжении развития Pleistophora typicalis, паразита скелетной мускулатуры рыбы Myoxocephalus scorpius, стадии развития заключены в толстую аморфную оболочку спорофорного пузырька. Многоядерные мерогональные плазмодии в результате плазмотомии образуют одноядерные стадии. Развивающиеся из них многоядерные спорогональные плазмодии проходят поэтапную плазмотомию, образуя одноядерные споробласты и микроспоры. Восьмиядерные плазмодии дают начало 8 макроспорам. Тонкое строение микро- и макроспор одинаково.
У диплокариотических родов, типичным примером которых служит Nosema, оба ядра не дифференцированы по полу и не участвуют, как предполагалось ранее, в автогамии, представляя собой самый инертный ядерный аппарат микроспоридий. Вавра (Vavra, 1976b) предположил, что при каждом делении диплокариона в дочерние клетки попадают половинки от разных партнеров, что приводит к рекомбинации генов. По мнению Исси (1986), диплокарион, функционирующий как одно ядро, как бы делит набор хромосом клетки на 2 меньших набора, увеличивая частоту «соматических кроссинговеров». Примечательно то, что формы микроспоридий с такой организацией ядерного аппарата относятся к наиболее агрессивным и патогенным паразитам, способным к заражению новых, часто систематически далеких, хозяев. Поэтому появление диплокарионов можно оценить как прогрессивное приобретение в эволюции микроспоридий, компенсирующее этим формам отсутствие кариогамии.
Однако развитие типично диплокариотических форм происходит различным образом, что позволяет выделить не менее 4 типов жизненных циклов. К диплокариотическим родам, развивающимся в прямом контакте с цитоплазмой клетки хозяина и имеющим диспоробластическую спорогонию, относятся Nosema, Anncaliia, Bacillidium, Brachiola (паразит человека), Hirsutosporos, Hrabeyia, Jirovecia, Mrazekia, Rectispora.
В прямом контакте с цитоплазмой клетки хозяина, образуя розетковидный споронт и затем много спор, развиваются Caudospora (4 - 8), Ringueletium(8), Weiseria (16—22).
В прямом контакте с цитоплазмой клетки хозяина, образуя лентовидный споронт и 8 спор, развивается Vittaforma, паразитирующая в роговице глаз человека. На всем протяжении развития клетки паразита окружены ШЭР клетки хозяина. Сходным образом в клетках соединительной ткани рыб развивается Ichthyospoidium. Но его развитие сопровождается образованием ксеном и огромных опухолей, окружающих паразитов.
И наконец, у таких полиспоробластических родов, как Binucleospora (16—32), Campanulospora (2, 4), Octosporea (8), Pseudopleistophora (до 12) и Scipionospora (4), стадии спорогонии отграничены от цитоплазмы клетки хозяина оболочкой спорофорных пузырьков.
Значительно большим единообразием характеризуются жизненные циклы микроспоридий, мерозоиты и споронты которых имеют диплокариотический аппарат, а в результате мейоза образуется 8 (или число, кратное 8) одноядерных споробластов и спор одного типа. Спорогония большинства этих форм протекает в спорофорных пузырьках, но несколько родов развивается "в прямом контакте с цитоплазмой клетки хозяина.
Сложные жизненные циклы микроспоридий выявлены недавно. Около 30 лет тому назад Пилли (Pilley, 1976) впервые описан цикл развития Vairimorpha nеcatrix, завершающийся двумя спорогониями. А через 10 лет появилось описание полиморфного диксенного жизненного цикла Amblyospora dyxenoides с двумя спорогониями в основном хозяине — комаре Culex аnnulirostris (Diptera, Culicidae) и с третьей спорогонией в дополнительном — циклопе Mesocyclops albicans (Copepoda, Cyclopidae) (Sweeney et al., 1985).
У микроспоридий рода Vairimorpha доминируют диплокариотические стадии и диспоробластическая спорогония, все стадии находятся в прямом контакте с цитоплазмой клетки хозяина, ничем не отличаясь от стадий ноземы. Именно поэтому многие виды этого рода ранее были отнесены к роду Nosema. Другой этап жизненного цикла сходен с циклом развития рода Thelohania. Диплокариотический споронт окружается оболочкой спорофорного пузырька, в результате мейоза образуется 8-ядерный розетковидный плазмодий. Он делится на 8 споробластов, затем на 8 одноядерных спор. Оба типа спор с изофилярными ПТ. Виды этого рода паразитируют в чешуекрылых насекомых, и 8-споровую спорогонию у них провоцирует осеннее понижение температуры. У такого вида, как V. mesnili, 8-споровый этап развития наблюдается один раз в 4—8 лет, что свидетельствует о процессе его редукции (Sokolova et al., 1993; Соколова, Исси, 1997).
Полиморфные микроспоридии делятся на группу родов с моноксенными жизненными циклами, развитие которых с образованием спор трех типов проходит в одном хозяине, и на группу родов с диксенными жизненными циклами, когда половой процесс и две спорогонии проходят в основном хозяине, комаре, а третья спорогония — в дополнительном, циклопе.
Характерным примером первого типа развития служит жизненный цикл видов рода Culicosporella, развивающихся на начальных этапах в гемоцитах, затем в жировом теле кровососущих комаров. В личинках диплокариотические меронты образуют диплокариотические споронты двух типов. Вокруг споронтов первого типа возникает эфемерная оболочка спорофорного пузырька. Спорогональный плазмодий розетковидной формы дает начало 8 двухъядерным тонкостенным спорам, осуществляющим горизонтальную передачу микроспоридий. Споронты второго типа, также в спорофорном пузырьке, проходят кариогамию и после мейоза образуют 2—8 одноядерных толстостенных спор. В эпителии яичников самок взрослых комаров образуются крупные двухъядерные (похожие на нозему) споры трансовариальной передачи.
Второй тип жизненного цикла описан для родов Amblyospora и Parathelohania. Развитие в копеподах начинается с 1—2-ядерных гаплоидных меронтов. Стадии спорогонии в спорофорных пузырьках или без них. Розетковидный споронт делится, образуя 4—8 одноядерных тонкостенных спор с изофилярной ПТ. Эти споры, высвобождаясь, заражают личинок комаров. Одноядерные меронты в эндоцитах личинок образуют клетки грушевидной формы — гаметы, которые попарно сливаются, а их ядра, сближаясь, образуют диплокарион. Предполагается, что позднее сливаются и ядра диплокариона. Диплоидный споронт превращается в двухъядерные цилиндрические споры трансовариальной передачи. В личинках 1—2 возрастов следующего поколения, выщедщих из зараженных яиц, диплоидные меронты развиваются в гемоцитах. С 3-го возраста развитие проходит в жировом теле. Диплокариотический споронт после мейоза образует восемь гаплоидных мейоспор. Эти одноядерные толстостенные споры с анизофилярной ПТ заключены в спорофорный пузырек. После гибели личинок комаров они, высвобождаясь, служат источником заражения для копепод. По нашим данным, часть популяции паразитов постоянно поддерживается в популяции хозяина путем трансовариальной передачи.
Современная ситуация в систематике микроспоридий не исключает того, что многие из известных родов, образующих один или два типа спор, в действительности представляют собой только один из этапов жизненного цикла полиморфных диксенных родов. Большинство микроспоридий описано на основании морфологических и ультраструктурных признаков спорогональных стадий, в то время как мерогония этих форм, а также возможность развития в дополнительных хозяевах (которых трудно выявить из-за несовпадения сроков развития основного и дополнительного хозяев) остаются неизученными.
ПРОДОЛЖИТЕЛЬНОСТЬ РАЗВИТИЯ.
У микроспоридий насекомых, длительность развития которых установлена экспериментальным путем, самые короткие жизненные циклы — от споры до споры — выявлены у многих нозем чешуекрылых и равны 3—5 суткам. В тех случаях, когда спорообразование паразита приурочено к определенной фазе развития насекомых и регулируется, вероятно, гормонами хозяина (часто отмечается для паразитов жуков), развитие микроспоридии длится от момента заражения до достижения насекомым этой фазы. В весенне-летний сезон оно может превышать месяц, а при уходе личинок после заражения в диапаузу и на зимовку — достигать нескольких месяцев. Самое длительное прохождение полного жизненного цикла установлено для микроспоридий рода Amblyospora, паразитирующих у моновольтинных видов комаров. Споры, развившиеся в рачках, заражают личинок ранневесенних комаров уже на следующий год. В этих личинках у микроспоридий происходит половой процесс, в результате которого диплокариотические споры трансовариальной передачи образуются только во взрослых самках. На следующий год из отложенных этими самками зараженных микроспоридиями яиц появляются личинки, в которых развиваются гаплоидные октоспоры паразитов. После гибели личинок комаров (в основном самцов) и выхода в воду мейоспоры заражают циклопов в этот же или часто на следующий год. Таким образом, на прохождение полного цикла развития этих паразитов уходит 2—3 года. Однако этим микроспоридиям свойственен также «страховочный» вариант жизненного цикла — постоянная передача паразитов от поколения к поколению трансовариальным путем.Пути передачи микроспоридий. Основной путь проникновения микроспоридий в организм хозяина — пероральный, обычно вместе с пищей, загрязненной спорами, или при поедании зараженных особей. Микроспоридии беспозвоночных животных передаются потомству трансовариальным, реже трансспермальным путем, а микроспоридии высших позвоночных животных — трансплацентарным путем. Некоторые микроспоридии насекомых распространяются в популяции основного хозяина его паразитами. При этом энтомофаги либо сами заражаются микроспоридиями своего хозяина, либо разносят споры механически, при поочередном прокалывании яйцекладом кутикулы больных и здоровых особей хозяина. Заражение микроспоридиями теплокровных животных при укусах кровососущих насекомых пока не установлено. Попавшие в кишечник, гемолимфу или кровеносный сосуд споры выстреливают ПТ и вводят зародышей в клетки хозяина. Наличие у некоторых видов микроспоридий беспозвоночных нескольких путей передачи от одной особи хозяина к другой и смена одного пути передачи другим в зависимости от условий (главным образом плотности популяции хозяина) — один из важнейших механизмов стабилизации паразито-хозяинной системы на популяционном уровне взаимоотношений партнеров.
Локализация (гистотропия) микроспоридий.
Некоторые микроспоридии инвазируют все ткани и органы своего хозяина, другие — только немногие или одну ткань, значительно реже встречаются паразиты, инвазия которых ограничена несколькими клетками (обычно эноцитами). Наиболее предпочитаемыми для микроспоридий являются клетки тканей и органов, либо богатых энергетическими ресурсами (жировое тело насекомых, клетки яичников, нервная система позвоночных), либо характеризующихся высоким уровнем обменных процессов (секретирующие эпителии различных желез, опухолевые клетки позвоночных животных). Некоторые из них (Pleistophora) избирают мышечные ткани. Микроспоридии могут паразитировать в животном-хозяине на всем протяжении его развития либо только в определенной стадии его развития. Так, у насекомых есть виды, заражающие только личинок (Gystosporogenes schubergi) или только взрослых особей (Nosema apis) своего хозяина. Микроспоридии трематод обычно паразитируют либо у редий и спороцист, либо у марит.
ПАРАЗИТО-ХОЗЯИННЫЕ ОТНОШЕНИЯ МИКРОСПОРИДИЙ И ЖИВОТНЫХ-ХОЗЯЕВ.
Изучение паразито-хозяинных отношений микроспоридий и заражаемых ими животных, оценка роли паразитов в развитии патогенных процессов при мик- роспоридиозах и в подавлении защитных реакций животного-хозяина проводятся на всех уровнях организации живого — от субклеточного до биоценологического.Симптомы микроспоридиоза. У беспозвоночных животных с прозрачными покровами очаги инвазии микроспоридий становятся белыми после образования спор. У позвоночных животных образуются ксеномы, заметные невооруженным глазом, а инвазированные микроспоридиями волокна поперечно-полосатой мускулатуры при вскрытии животного видны как белые штрихи. Вследствие влияния микроспоридий на обменные процессы и гормональный статус у зараженных насекомых могут изменяться окраска тела и поведение, нарушаться метаморфоз и диапауза.
Специфичность. Среди микроспоридий имеются узкоспецифичные виды, развивающиеся в одном виде хозяина (иногда даже только в одной из его стадий), и виды, заражающие широкий круг хозяев, связанных родственно (виды одного рода или представители одного семейства) или экологически (насекомое-хозяин, его паразиты и гиперпаразиты). Так, Vairimorpha mes- nili заражает таких параксенных хозяев, как чешуекрылое насекомое — капустная белянка Pieris brassicae, ее перепончатокрылые паразиты Pteromalus puparum и Apanteles glomeratus и перепончатокрылый гиперпаразит последнего — Dibrachis cavus. Кроме капустной белянки она заражает и другие виды белянок с их паразитами и гиперпаразитами, образуя сложную паразитарную систему. Наиболее агрессивные и часто менее специализированные формы представлены видами рода Nosema и обычно т’ех родов, в жизненном цикле которых имеется спорогония ноземного типа. Ярким представителем широко специализированного вида микроспоридий можно назвать Nosema algeri (Brachiola) из личинок кровососущих комаров, которая в эксперименте легко заражает чешуекрылых и жесткокрылых насекомых, а также бестимусных мышей. Узкой специализацией отличаются виды, имеющие сложные циклы развития, которые проходят в двух хозяевах.
Взаимоотношения микроспоридий с клеткой. Экологической нишей для таких крайне мелких паразитов, как микроспоридии, служит клетка, вернее один из ее компартментов. Они активно внедряются в клетку путем механической перфорации клеточной мембраны и введения зародыша непосредственно в клетку. Если мембрана клетки после прокола натекает на трубку, клетка выживает, но, если она не изменяется, как у эритроцитов, клетка погибает. Микроспоридии на всех этапах развития нуждаются в экзогенной АТФ, присутствующей в цитоплазме клетки хозяина (Trager, 1974). Она необходима простейшему, не имеющему собственных митохондрий, для функционирования ферментов и транспорта веществ на мембранах, отделяющих паразита от цитоплазмы клетки хозяина. Зародыши, не попавшие в клетку хозяина, погибают.
Большинство микроспоридий развивается в цитоплазме, но при сильном заражении клетки часть особей может проникнуть в ее ядро. Обычно это происходит при делении ядра и разрушении его оболочки. Микроспоридии сем. Chytridiopsidae, паразитирующие в жуках и мидиях, все свое развитие проходят в тесном контакте с ядром клетки. На полутонких срезах видно, что паразиты находятся либо в перинуклеарном пространстве и отграничены и от ядра, и от цитоплазмы клетки хозяина мембранами, составляющими продолжение мембран ядра хозяина, либо, находясь в цитоплазме, лежат в чашевидном углублении ядра. Паразит рыб Nucleospora salmonis развивается в ядрах гемопоэтических клеток.
Большинство микроспоридий в отличие от других внутриклеточных паразитов животных развивается в прямом контакте с цитоплазмой инвазированной клетки. Классическая паразитофорная вакуоль описана только для видов рода Encephalitozoon, паразитирующих в теплокровных животных. У рыб и беспозвоночных известно более 20 родов, развитие которых проходит в вакуолях, значительно отличающихся от паразитофорной вакуоли Е. cuniculi тем, что их стенки представлены мембранным континуумом ШЭР или другими мембранными образованиями(Исси и др., 2001). Учитывая то, что такие вакуоли обычно образуются в эпителии кищечного тракта, месте первичной инвазии большинства паразитов, можно предположить, что их образование свидетельствует о недавнем становлении паразито-хозяинных отношений. Об этом же говорит и то, что виды, не вызывающие образования паразитофорной вакуоли у своего хозяина, часто индуцируют ее в экспериментальном хозяине.
Сразу после проникновения микроспоридий в клетку явных изменений в окружающей паразита цитоплазме не происходит. Затем ШЭР и митохондрии клетки хозяина концентрируются вокруг паразитов, при этом число митохондрий на единицу объема цитоплазмы увеличивается. Одновременно возрастает поглощение митохондриями зараженной клетки кислорода (Бабурина и др., 1989), что говорит об усилении активности энергетического обмена зараженной клетки. У двукрылых насекомых сем. Sciaridae возрастают синтез нуклеиновых кислот (до 32 раз) и политенность хромосом в зараженных клетках слюнных желез (Roberts et al., 1967). Стимуляцию клетки на начальных этапах инвазии можно рассматривать как следствие ее компенсаторных и репаративных реакций, поддержанных организмом.
Особенно интересны взаимоотношения микроспоридий с митохондриями клетки хозяина, они варьируют от полного отсутствия видимой реакции этих органелл на инвазию паразитов до интеграции клетки паразита с митохондриями клетки хозяина (Durfort, Vallinitjana, 1982). На электронограммах многих микроспоридий видны структурированные связи между мембранами органеллы и клетки паразита. Микроспоридии названы паразитами энергетических систем клетки хозяина (Trager, 1974).
На этапе мерогонии в цитоплазме клетки хозяина вокруг паразитов появляется сеть трубчатых структур(tubular net), представляющих выросты плазматической мембраны их клеток. По мере развития паразитов эти структуры видоизменяются и к концу спорогонии исчезают. Их функциональное назначение не выяснено, наиболее вероятно участие в обменных процессах между клетками паразита и хозяина.
С началом спорогонии начинается гипертрофия клеток хозяина. На этом этапе происходят деструктивные изменения клетки хозяина: исчезают ШЭР, жировые и протеиновые гранулы, число рибосом уменьшается в цитоплазме и одновременно увеличивается по периферии ядра, деградируют митохондрии. Гипертрофированным клеткам свойственна гипертрофия ядра с сильной инвагинацией его оболочки и образованием лопастей, увеличивающих его поверхность, или даже появление многоядерности. Наиболее сильные патологические изменения свойственны клеткам мезодермального происхождения (Исси, 1983). Зараженные клетки, потеряв способность к автолизису, часто живут дольше незараженных. При метаморфозе насекомых они, не подвергаясь апоптозу в отличие от нормальных, трансфазно передаются от личинок взрослым особям. Взаимоотношения на организменном уровне.
Микроспоридии беспозвоночных, постепенно заселяя определенную ткань, орган, или же весь организм хозяина, в своем большинстве вызывают длительные хронические заболевания с постоянной гибелью части особей в критические периоды развития (при линьках, метаморфозе, миграциях) или при любом отклонении условий среды от оптимума (критические температуры, засуха, нехватка корма). Эффект прямой смертности от микроспоридиоза регистрируется реже, чем смертность вследствие падения жизнеспособности. Однако некоторые микроспоридии постоянно служат причиной как массовых эпизоотий, так и массовой гибели своих хозяев. В первую очередь к ним относятся микроспоридии, инвазирующие эпителий кишечника или шелкоотделительных желез. В этих случаях основные причины гибели проявляются либо диареей с обезвоживанием организма, либо отравлением продуктами метаболизма, которые не востребованы железами.
Заражение микроспоридиями жирового тела приводит к нарушениям метаморфоза и резкому падению плодовитости больных насекомых. У многих личинок не формируются имагинальные диски и зачатки половых желез или же их клетки теряют способность к дифференциации, что накладывает запрет на нормальное развитие самих насекомых или их половой продукции (Исси, Онацкий, 1984; Онацкий, Исси, 1982). Реже микроспоридии вызывают паразитическую кастрацию насекомых обоих полов, при этом репродуктивные органы не развиваются вообще. При микроспоридиозе обычен гормональный дисбаланс, выражающийся в добавочных линьках, нарушениях метаморфоза и фотопериодической реакции насекомых (Исси, Токарев, 2002). Зараженные особи могут жить дольше незараженных, погибая при появлении личинок следующего поколения. Такая особенность патологии хозяина способствует сохранению паразитов в его популяции и их непосредственной передаче от одного поколения другому.
У бокоплавов рода Gammarus микроспоридии, подавляя функцию андрогенных желез, детерминируют пол хозяина — из зараженных личинок развиваются только самки, передающие паразитов следующему поколению трансовариальным путем. У некоторых насекомых под влиянием заражения изменяется поведение: они не спускаются с растений в дневные часы или откладывают яйца в несвойственных этому виду хозяина местах.
Биохимические исследования паразито-хозяинных отношений микроспоридий и насекомых показали отклонения и в составе белков, и в ферментативной активности зараженных особей. Изучение состава белков в жировом теле и гемолимфе двупятнистого сверчка Gryllus bimaculatus, зараженного микроспоридией Paranosema (Nosema) grylli, выявило исчезновение резервных личиночных белков с молекулярным весом 60 kDa, которым приписывается важная роль в процессах линьки и метаморфоза (Селезнев и др., 1997). При изучении активности ферментов энергетического и углеводного обмена у зараженных насекомых показано усиление активности глицерол 3-фосфатдегидрогена- зы и пируваткиназы, говорящее об усилении энергетического обмена в зараженных клетках (Долгих и др., 1996, 1997; Долгих, 1998, 2002).
Эксперименты по оценке влияния факторов среды второго порядка (окружающей среды) на взаимоотношения партнеров паразито-хозяинной системы показали, что температурный оптимум обоих партнеров системы совпадает, а кормовой режим, наиболее благоприятный для хозяина, приводит к интенсивному размножению и более быстрому спорообразованию паразитов. Таким образом, пусковые механизмы массового размножения насекомого-хозяина (часто вредителя) и его облигатного паразита — микроспоридии одинаковы, что приводит к одновременному росту численности популяций обоих партнеров (Исси, 1986).
Популяционные взаимоотношения микроспоридий и насекомых. Особенности отношений популяций микроспоридий и животных-хозяев были изучены только для паразитов насекомых. Для многих насекомых, обитающих в природных биоценозах или в агроценозах, характерны периоды с высокой численностью и, следовательно, с высокой плотностью особей. К таким насекомым относятся многие вредители сельскохозяйственных культур, древесных насаждений и леса, а также обитатели небольших или временных водоемов, в которых по мере высыхания воды резко возрастает плотность заселения. При наличии в таких популяциях микроспоридий увеличение числа контактов между особями хозяина может привести к быстрой горизонтальной передаче паразитов и возникновению эпизоотий, что, однако, происходит не всегда. Рассмотрим два контрастных примера.
Многолетние наблюдения (Исси, 2002) за популяциями капустной белянки Pieris brassicae и микроспоридии Vairimorpha mesnili, показали, что на Северо-Западе европейской части России и в Прибалтике регулярно возникают очаги микроспоридиоза. Зараженность белянки не падает ниже 10—12 % на культурных растениях и 1—4 % на диких крестоцветных. С периодичностью один раз в четыре года зараженность популяций к осени возрастает до 90—100%, причем эпизоотия охватывает огромные территории от Петрозаводска на севере через западные районы Ленинградской и Псковской областей до Белоруссии, включая Эстонию и Латвию. Анализ зараженности популяций на изолированных участках — островах в Балтийском море (о-в Саарема) или полях среди лесных массивов Карелии —2 показал, что она близка к тому уровню, что и на всей остальной территории.
Анализ погодных условий в эти годы показал, что выход вредителя из-под контроля паразитов в природных условиях провоцируется высоким уровнем и продолжительностью солнечного сияния. В силу совпадения оптимумов пусковой механизм массового размножения насекомых-хозяев служит и пусковым механизмом массового размножения паразитов. Высокая плотность популяции насекомых создает условия для повышения вирулентности микроспоридий — преимущество получают формы с короткими жизненными циклами, вызывающие быструю гибель хозяина, вследствие которой споры попадают во внешнюю среду и заражают алиментарным путем новых насекомых. Заболевание быстро распространяется среди насекомых, контактирующих друг с другом. В течение одного сезона зараженность популяции возрастает до 100 %, заканчиваясь массовой гибелью и хозяина, и паразита.
При снижении плотности популяции преимущество получают слабопатогенные формы, «позволяющие» хозяину развиться до взрослого состояния и отложить яйца, в которых микроспоридии перейдут к следующему его поколению. Таким образом, смена путей передачи паразитов — Перорального при высокой плотности хозяина на трансовариальный при низкой — один из механизмов, обеспечивающих динамическое равновесие партнеров паразитарной системы и стабильность самой системы. Наличие у V. mesnili трех путей передачи (перорального, трансовариального и энтомофага- мии) говорит о том, что данная система складывалась в условиях низких численности и плотности насекомого-хозяина. Действительно, за 20 лет наблюдений зараженность белянки на диких крестоцветных не превышала 20 %. Введение в культуру высокопродуктивных сортов растений послужило причиной массовых размножений фитофага, не свойственных ему в природе. Из этого следует, что массовые эпизоотии микроспоридиозов у вредителей культурных растений могут быть таким же следствием человеческой деятельности, как и массовые размножения насекомых-вредителей.
Паразито-хозяинные отношения в дикой природе даже при условии высоких численности и плотности насекомых более устойчивы, так как в этих паразитарных системах в ответ на регулярное повышение плотности популяции хозяина (например, при высыхании временных водоемов) в процессе эволюции возникли механизмы, ограничивающие горизонтальное распространение паразитов. У комаров к таким механизмам можно отнести массовое образование спор в личинках только самцов и непременное заражение ими дополнительного, часто менее массового хозяина. Существующий у них же запасной вариант передачи микроспоридий через зараженных самок обеспечивает поддержание наименее вирулентных форм, поэтому зараженность «диких» популяций редко превышает 8—12%. У многих жуков низкая зараженность популяции микроспоридиями поддерживается созреванием спор только во взрослых особях хозяина, ведущих одиночный образ жизни, в отличие от личинок.
ПРАКТИЧЕСКОЕ ЗНАЧЕНИЕ МИКРОСПОРИДИЙ.
Практическое значение этих паразитов существенно. Вызываемые микроспоридиями заболевания имеют для человека как отрицательные, так и положительные последствия. Почти 150 лет отмечают значительные хозяйственные потери на шелководнях и пасеках вследствие эпизоотий нозематозов у тутового Воmbух mori и дубового Antheraea реrnу шелкопрядов, у пчел Apis mellifera; описаны случаи массовой гибели других полезных беспозвоночных животных: насекомых-эн- томофагов, насекомых-опылителей; ракообразных — речного рака Astacus astacus и крабов; моллюсков — мидии Mytilus edulis при промышленном разведении.Широко распространены микроспоридии у рыб, инвазируя у них мускулатуру (Pleistophora), соединительную ткань и кишечник (Glugea), репродуктивные органы (Glugea, Coccospora) и даже центральную нервную систему (Spraguea lophii). Зафиксированы случаи массового заражения (до 70—100 %) микроспоридией Glugea takedai икринок у производителей горбуши Oncorhynchus gorbuscha и симы О. masou, приводящие к резкому падению плодовитости этих рыб (Вялова и Воронин, 1987).
Случаи заболевания микроспоридиозом птиц и млекопитающих, в первую очередь хищников при их содержании в неволе (в зоопарках или на пушных фермах), как правило, заканчиваются гибелью больных животных или их потомства, трансплацентарно зараженного микроспоридией Encephalitozoon cunicu- Н. Постоянно болеют микроспоридиозом грызуны, особенно живущие рядом с человеком (мыши, кролики). Анализ состояния грызунов в городских условиях выявил до 40 % особей, зараженных микроспоридиями, но случаи гибели этих животных относительно редки.
Особую проблему представляют микроспоридиозы человека. До недавнего времени были известны единичные случаи заражения микроспоридиями людей, работающих в крольчатниках или на пушных фермах. Микроспоридия Е. cuniculi, паразитирующая на кроликах, способна заразить человека с нормальной иммунной системой. В настоящее время на фоне снижения иммунитета под воздействием иммунодепрессантов или отрицательных факторов среды и главным образом при заболевании СПИДом резко возросло значение микроспоридий как возбудителей оппортунистических заболеваний человека. У больных СПИДом уже выявлено 13 видов этих паразитов (Wittner, Weiss, 1999; Franzen, Muller, 2001), вызывающих разнообразные заболевания; поражение глаз — кератит и блефарит, хроническую диарею или генерализованную миопатию с летальным исходом. По особенностям ультраструктуры клетки одни микроспоридии представляют собой формы со сложно устроенными спорами (Тгас- hipleistophora), в то время как другие относятся к примитивным формам, образуя споры со слабо развитым аппаратом экструзии (Enterocytozoon). В пользу разного времени освоения микроспоридиями человеческого организма говорит и то, что более примитивная микроспоридия инвазирует ткани кишечника, а более высоко организованная — мышечную ткань. Несомненно интересным можно считать и то, что эти виды ранее у человека обнаружены не были. Сейчас нет убедительных доказательств ни в пользу того, что эти микроспоридии циркулируют в популяциях людей, не проявляя патогенных свойств при нормальном иммунитете, ни того, что они переходят к человеку с нарушенной иммунной системой от других животных. Все же этот настораживающий факт заставляет исследователей искать в основном у кровососущих насекомых микроспоридий, которые могут вызвать заражение человека при попадании в кровь. Так, например, микроспоридией Brachiola algeri (= Nosema algeri) из кровососущих комаров в эксперименте удалось заразить бестимусных мышей, внеся суспензию спор в глаза животных.
В связи с тем что для большинства микроспоридий беспозвоночных температуры выше 30 °C сублеталь- ны или задерживают их развитие, считается, что температура человеческого тела, достигающая 37—38 °C, служит надежным барьером при заражении микроспоридиями. Однако нельзя забывать, что близкую температуру имеют общественные перепончатокрылые насекомые (30—32 °C) и могут иметь некоторые виды блох, развивающихся подкожно у грызунов с более высокой, чем у человека, температурой тела.
В то же время высокие патогенные свойства микроспоридий при паразитировании на вредных видах членистоногих или гельминтов позволяют рассматривать этих паразитов как перспективных агентов биологического метода борьбы с этими животными. В середине XX в на микроспоридий обратили внимание ветеринары, паразитологи и специалисты по биологическим методам борьбы. К реализации идеи практического использования микроспоридий против насекомых сельскохозяйственного, медицинского и ветеринарного значения одним из первых приступил чешский исследователь Вайзер (Weiser, 1961, 1966). Эта идея привлекла ученых многих стран, что нашло выражение в описании новых видов микроспоридий, их жизненных циклов и особенностей взаимоотношений с животными-хозяевами.
Особый интерес представляют микроспоридии комаров, которые не только вызывают высокую смертность личинок и снижают плодовитость взрослых самок, но и при одновременном заражении малярийными плазмодиями подавляют развитие нескольких их видов.
Изучение массовых эпизоотий микроспоридиоза в популяциях насекомых — вредителей сельского и лесного хозяйства позволяет говорить о двух реальных путях использования микроспоридий против вредных видов. Это, во-первых, внесение в биоценоз спор, полученных при массовом разведении микроспоридий на насекомых лабораторных линий, и, во-вторых, прогноз естественных эпизоотий микроспоридиоза в целях отмены обработок пестицидами, что не только уменьшит затраты на выращивание культурных растений, но и снизит токсическую нагрузку на биоценоз.
Кроме того, микроспоридии представляют собой уникальный обьект лабораторных исследований. Во-первых, кроме микроспоридий нет других внутриклеточных паразитических эукариотов, распространившихся среди животных всех уровней организации. Имея представления о том, что характер воздействия микроспоридий на инвазированную клетку практически одинаков у всех животных-хозяев, мы можем рассматривать их как группу, чрезвычайно интересную для сравнительных исследований защитных реакций организма разных животных на внедрение внутриклеточных паразитов. Во-вторых, клетка микроспоридий, имеющая в сравнении с другими эукариотами один из самых маленьких геномов и утерявшая в процессе адаптации к паразитизму многие органеллы, как минимальная клеточная система может быть интереснейшим объектом для цитологов и молекулярных биологов.
ФИЛОГЕНИЯ.
Микроспоридии как одноклеточные эукариотные организмы относятся к типичным протистам. Уникальность их строения указывает на то, что это моно- филетичная группа, происхождение которой и родственные связи с другими организмами продолжают оставаться предметом дискуссии. Кавалье-Смит (Cavalier-Smith, 1998, 2001) на основании сходства микроспоридий с грибами по таким признакам, как диплокариотическая организация ядерного аппарата, наличие хитина в оболочке спор, сходство последовательностей а- и р-тубулинов, отнес их к царству грибов Fungi сперва как группу сильно редуцированных вследствие паразитизма организмов, близких к дрожжевым грибам, затем в качестве одной из примитивных групп, не относящихся ни к одной современной группе грибов.Эта точка зрения находится в некотором противоречии с рядом биологических характеристик микроспоридий. Кроме рРНК прокариотного типа и отсутствия митохондрий, которые, как теперь установлено, есть следствие редукции этих органелл в результате переложения паразитами их функций на клетку хозяина, микроспоридий характеризуют другие примитивные признаки, которые, по нашему мнению, говорят об их очень раннем становлении как самостоятельной группы. К ним можно отнести: связь наиболее примитивных форм с океаническими животными (микроспоридии сем. Metchnikovellidae известны как гиперпаразиты океанических многощетинковых червей Polychaeta); инициацию экструзии зародышей разнообразными факторами, приводящую к их значительным потерям; монокарион примитивных форм (более 40 % родов) на всем протяжении жизненного цикла и отсутствие у них мейоза; попадание в клетку хозяина путем механического прокола ее оболочки — все это свидетельства в пользу сохранения микроспоридиями древних признаков на фоне высочайших биохимической и физиологической адаптаций к внутриклеточному паразитизму, сопровождавшихся редукционными процессами.
Кроме того, освоение микроспоридиями в качестве хозяев представителей всего царства животных также отличает их от тех протистов, которые, перейдя к паразитическому образу жизни позднее микроспоридий, смогли освоить только какую-то определенную группу животных. Вероятно, эта противоречивость характеристик послужила поводом для сравнения микроспоридий с основной группой грибов Chytridiomycota и Zygomycota (а не с нерепрезентативными выборками при небольшом числе видов базидио- и аскомицетов, как у других авторов) по признакам, не использованным ранее. Японские исследователи (Tanabe et al., 2002) по результатам исследования RPBI (2-й большой субъединицы ДНК-зависимой полимеразы РНК) и EF-la (фактора трансляционной 1-а элонгации) у микроспоридий и базальной группы грибов сделали вывод, что сравнение последовательностей этих двух белков свидетельствует не в пользу близких отношений микроспоридий и грибов. Более того, авторы показали, что для микроспоридий не характерна делеция двух аминокислот в белке EF-la, имеющая диагностическое значение для всех грибных сиквенсов.
Жизненные циклы микроспоридий и преобразования их ядерного аппарата позволяют представить возможные взаимоотношения между различными группами. Самые примитивные микроспоридии (монокарио- тические формы как с примитивным, так и с хорошо развитым аппаратом экструзии) паразитируют на других протистах (грегаринах или инфузориях, заражающих свободно живущих кольчатых червей или трематод), на полихетах и на бескрылых насекомых.
Усложнение ядерного аппарата — появление дип- локариона и мейоз при переходе от мерогонии к спорогонии — свидетельствует о прогрессивном развитии этих форм при переходе к паразитированию на более высоко организованных животных — членистоногих и рыбах. За ядерными преобразованиями следует усложнение циклов и дополнение их этапом диплокариоти- ческой спорогонии. Усложнение циклов связано с паразитированием микроспоридий на хозяевах, ведущих гетеротопный (водно-наземный) образ жизни. Диплокариотические особи микроспоридий, развивающиеся в наземных стадиях этих насекомых, как наиболее агрессивная форма жизненного цикла с возможностями широкой специфичности и высокой лабильностью своих реакций осуществили возможность завоевания многих сухопутных хозяев и постепенно стали существовать как самостоятельные виды. В этом отношении интересен диплокариотический род Nosema. Как показали результаты молекулярно-биологических исследований, одни виды нозем (главным образом из чешуекрылых) близки к видам диморфного рода Vai- rimorpha, в то время как другие (из прямокрылых и жесткокрылых насекомых) родственны микроспоридиям полиморфного рода Amblyospora из водных насекомых (что стало обоснованием для вывода из рода Nosema видов, паразитирующих на прямокрылых, и для описания нового рода Paranosema) (Sokolova et al., 2003). Некоторые микроспоридии, в жизненном цикле которых преобладает диплокариотический этап, сохраняют часть цикла с монокариотическими формами, другие же его теряют. В этом отношении очень показателен жизненный цикл такого вида, как Vairimorpha mesnili (Nosema mesnili), у которого моно- кариотический этап цикла выявляется один раз в 4—8 лет, он как бы постепенно редуцируется на наших глазах.
Книги:
 Протисты. Руководство по зоологии. Часть 1. Алимов А.Ф. 2000
Протисты. Руководство по зоологии. Часть 1. Алимов А.Ф. 2000
 Протисты. Руководство по зоологии. Часть 2. Алимов А.Ф. 2007
Протисты. Руководство по зоологии. Часть 2. Алимов А.Ф. 2007
 Протисты. Руководство по зоологии. Часть 3. Алимов А.Ф. 2011
Протисты. Руководство по зоологии. Часть 3. Алимов А.Ф. 2011
 Жизнь животных. Том 1. Простейшие. Кишечнополостные. Черви / В. Е. Соколов - 1987
Жизнь животных. Том 1. Простейшие. Кишечнополостные. Черви / В. Е. Соколов - 1987



 Зоология беспозвоночных. Функциональные и эволюционные аспекты. В 4 томах. / Рупперт Э.Э., Фокс Р.С., Барнс Р.Д. - 2008
Зоология беспозвоночных. Функциональные и эволюционные аспекты. В 4 томах. / Рупперт Э.Э., Фокс Р.С., Барнс Р.Д. - 2008
 Вестхайде В., Ригер Р. Зоология беспозвоночных. = Spezielle Zoology. Teil 1: Einzeller und Wirbellose Tiere / пер. с нем. О. Н. Бёллинг, С. М. Ляпкова, А. В. Михеев, О. Г. Манылов, А. А. Оскольский, А. В. Филиппова, А. В. Чесунов; под ред. А. В. Чесунова. — М.: Товарищество научных изданий КМК, 2008. — С. 366—423
Вестхайде В., Ригер Р. Зоология беспозвоночных. = Spezielle Zoology. Teil 1: Einzeller und Wirbellose Tiere / пер. с нем. О. Н. Бёллинг, С. М. Ляпкова, А. В. Михеев, О. Г. Манылов, А. А. Оскольский, А. В. Филиппова, А. В. Чесунов; под ред. А. В. Чесунова. — М.: Товарищество научных изданий КМК, 2008. — С. 366—423
 Биологический энциклопедический словарь под редакцией М. С. Гилярова и др., М., изд. Советская Энциклопедия, 1989
Биологический энциклопедический словарь под редакцией М. С. Гилярова и др., М., изд. Советская Энциклопедия, 1989