ОПИСАНИЕ:
Класс Kinetoplastidea Honigberg, 1963
Бесцветные жгутиконосцы, обладающие 2 гетеродинамными (или единственным, направленным вперед) жгутиками, отходящими от дна жгутикового кармана. Жгутики несут параксиальный тяж, который проходит параллельно аксонеме. Покровы представлены тубулёммой, степень целостности которой различна у отдельных представителей кинетопластид. Единственная митохондрия, часто имеющая сложную пространственную организацию, формирует специализированный участок — кинетопласт, который содержит всю или почти всю митохондриальную ДНК, или несколько дискретных ДНК-содержащих участков. Кинетопласт, как правило, тесно связан с базальной частью кинетосом жгутиков. Кинетоплас- тиды имеют 1 пузырьковидное ядро, деление которого осуществляется по типу закрытого внутриядерного плевромитоза, протекающе го без конденсации хромосом. Наличие полового процесса доказано, однако частота и формы его реализации пока неизвестны. Ротовой аппарат, включающий цитостом и цитофаринкс, стенки которых подстилаются микротрубочками, редуцирован у ряда кровепаразитов. Сократительная вакуоль, если имеется, открывается в жгутиковый карман. Одиночные, в исключительных случаях колониальные организмы; в жизненных циклах ряда видов отмечено закономерное формирование многоядерных особей. Свободноживущие гетеротрофы, комменсалы позвоночных и беспозвоночных животных, паразиты животных и растений. Описано около 1000 видов.В настоящее время к кинетопластидам относят 3 хорошо дифференцируемые группы жгутиконосцев: бодонид, криптобий и трипаносоматид. Бодониды, имеющие 2 свободных гетеродинамных жгутика, в подавляющем большинстве представлены свободноживущими формами, У криптобий, также имеющих 2 жгутика, направленный назад рекуррентный, или рулевой, жгутик прикреплен к телу клетки на значительном его протяжении. Большинство криптобий — комменсалы или паразиты беспозвоночных и позвоночных животных. Трипаносоматиды имеют только 1 направленный вперед жгутик. Все представители трипаносоматид — облигатные па разиты животных или растений.
ИСТОРИЯ ИЗУЧЕНИЯ
Поскольку многие представители трипаносоматид паразитируют в человеке, домашних животных и культурных растениях, зачастую вызывая их серьезные заболевания, эта группа кинетопластид всегда была в центре внимания ученых, являясь предметом многочисленных и разносторонних исследований. Именно этим объясняется богатая и динамичная история их изучения. Напротив, история изучения двухжгутиковых кинетопластид представляет собой монотонную хронологию описания их отдельных таксонов, начиная с работы Эренберга (Ehrenberg, 1830), описавшего род Bodo, и до наших дней. Эта группа кинетопластид долгое время оставалась в тени, и сегодня наши знания об эко логии, жизненных циклах и даже видовом разнообразии бодонид и криптобий очень бедны и фрагментарны.История изучения кинетопластид, вероятно, ведет свой отсчет от работ Антони ван Левенгука. Однако начало целенаправленного и интенсивного изучения группы можно датировать лишь серединой XIX столетия. Именно в это время в научной литературе начинают появляться отдельные описания кинетопластид, а уже в скором времени этот процесс принимает лавинообразный характер. Сразу вслед за свободноживущими Bodo (Ehrenberg, 1830) в поле зрения ученых попали трипаносомы из крови бесхвостых амфибий (Gluge, 1842), для которых и было предложено (Gruby, 1843) родовое название Trypanosoma. В это же время в литературе появляется описание криптобий из репродуктивных органов моллюсков (Leidy, 1846). К началу XX в. наука уже располагала многими фактами нахождения трипаносом в крови позвоночных животных, в том числе и млекопитающих. Так, в крови лошадей и верблюдов, болевших суррой, были обнаружены жгутиконосцы, названные впослед ствии в честь их первооткрывателя Т. evansi (Evans, 1880), а в крови крыс из Индии была описана Т. lеwisi (Lewis, 1878, 1879). Кроме того, оказалось, что трипаносомовые могут паразитировать и в кишечни ке беспозвоночных животных, в частности насекомых (Leidy, 1853, 1856; Kent, 1880). К этому периоду относятся и пионерские работы русских ученых Митрофанова (1883), Данилевского (1888) и Боровского (Боровский, 1898, — цит. по: Сафьянова, 1982). Последнему принадлежит приоритетное описание клинической картины кожного лейшманиоза (болезни Боровского) и доказательство протозойной природы его возбудителя Leishmania tropica. Несомненно, главным событием конца XIX в. стало многоплановое исследование Trypanosoma brucei — возбудителя наганы — распространенного в экваториальной Африке тяжелого заболевания домашнего скота. В серии исследований Давиду Брюсу (Bruce, 1895, 1897, 1902) удалось доказать, что это заболевание вызывается трипаносомами, которые передаются от больных животных здоровым через укус кровососущих насекомых — мух рода Glossina, и что резервуаром паразитов в природе служат дикие животные. Совокупность этих открытий, по сути, определила всю дальнейшую стратегию исследования трипаносоматид как возбудителей опасных трансмиссивных заболеваний человека и домашних животных, характеризующихся природной очаговостью. Работы Брюса явились своего рода детонатором, предопределившим исследовательский взрыв, пришедшийся на первое десятилетие XX в. В период с 1900 по 1911 г. были выявлены возбудители всех основных трипаносомозов и лейшманиозов на континентах Старого и Нового Света, описаны новые роды гетеро- и гомоксенных трипаносоматид, сведен ные наконец в одно сем. Trypanosomatidae (Grobben, 1905, — цит. по: Ноаге, 1972). Среди многочисленных исследований жизненных циклов трипаносоматид следует выделить работу Клейна (Kleine, 1909), который показал, что, проходя через переносчика, трипаносомы претерпевают определенное закономерное развитие, предшествующее формированию стадий, инфективных для позвоночных животных. Важным достижением этого периода явилась разработка метода лабораторного культивирования трипаносоматид (Novy et al., 1907) на искусственных кровьсодержащих средах (NN и NNN среды).
Накопление в литературе большого фактического материала не могло не повлечь за собой попыток к определенным теоретическим обобщениям. На данном этапе они вылились в полемику по вопросу о происхождении трипаносоматид (Leger, 1904а, 1904b; Woodcock, 1906; Minchin, 1908; Leger, Dubosq, 1910). В этом научном споре победу одержала гипотеза Леже, согласно которой предками трипаносом и лейшманий были гомоксенные жгутиконосцы из кишечника насекомых, произошедшие, в свою очередь, от гипотетических свободноживущих лептомонасподобных предков (Leger, Dubosq, 1910). Несколько позже такой свободноживущий жгугиконосец был найден Вудкокком (Woodcook, 1914) и назван Proleptomonas faecicola. Лишь спустя шестьдесят с лишним лет удалось показать, что Р. faecicola имеет отличную от кинетопластид организацию хондриома и двигательного аппарата и не может быть отнесен к этой группе жгутиконосцев.
Следующий период в истории изучения кинетопластид охватывает первую половину XX столетия. В это время появляется ряд крупных, обобщающих сводок, среди которых, бесспорно, выделяются соответствующие разделы в монографиях Веньона и Грассе (Wenyon, 1926; Grasse, 1952). На этом этапе начинается постепенное обособление научных школ, специализирующихся на изучении отдельных групп и даже отдельных видов трипаносоматид, которых разделяли на основании таксономических, клинических или географических критериев. Таким образом возникли группы ученых, изучающих различные лейшманиозы, африканские и южноамериканский три- паносомозы, трипаносомозы домашних животных и т. д. Часть трипаносоматид, не представляющая практического интереса, оказалась при этом фактически за чертой внимания исследователей.
Начало 60-х гг. открывает новейший период в истории изучения кинетопластид. Бурное развитие методов электронной микроскопии, биохимии и молекулярной биологии наряду с совершенствованием традиционных методов ставит исследование этой группы на качественно новый уровень. Так, выяснение природы и организации кинетопласта уже на ранних этапах этих исследований способствовало определению групп жгутиконосцев, в том числе и свободноживущих, родственных паразитическим трипаносоматидам. На основании этих данных Хо- нигберг в 1963 г. объединил бодонид, криптобий и трипаносоматид в 1 таксон Kinetoplastida (Honig- berg, 1963). Результатом дальнейшей интеграции научных знаний стало появление фундаментального многотомного издания «Биология кинетопластид» (Biology of.., 1976, 1979), в написании которого приняли участие практически все ведущие специалисты в данной области. Этот всеобъемлющий труд служит отправной точкой для большинства современных исследований. Вероятно, уже на этом этапе можно было ожидать и нового осмысления теоретических вопросов эволюции и филогении кинетопластид, поскольку была признана филогенетическая целостность кинетопластид, как свободноживущих, так и паразитических, и получены достаточно многочисленные данные по сравнительной цитологии различных представителей группы. Однако этого не произошло, и в дальнейшем авторы подтвердили приверженность традиционным представлениям о происхождении и эволюции группы.
80-е и начало 90-х гг. проходят под знаком интенсивного применения методов электронной микроскопии и молекулярной биологии в исследовании кинетопластид. Одним из важных событий последнего десятилетия стало доказательство наличия генетических обменов у трипаносоматид (Крылов и др., 1985; Tait, 1983, и др.). Наконец, комплексное сравнительно-морфологическое исследование кинетопластид позволило по-новому взглянуть на филогению этой группы (Фролов, 1993). Оказалось, что по целому ряду признаков трипаносомы гораздо ближе к двухжгутиковым кинетопласти- дам, чем «низшие» гомоксенные паразиты насекомых. В течение следующих пяти лет эта гипотеза нашла свое подтверждение в серии работ по сиквенсу генов рРНК у различных представителей кинетопластид и эвгленовых жгутиконосцев.
В настоящее время кинетопластиды являются одной из наиболее интенсивно изучаемых групп низших эукариот. Ежегодно в различных изданиях публикуются сотни работ, посвященных исследованию трипаносоматид и их ближайших родственников — бодонид и криптобий.
МОРФОЛОГИЯ
Кинетопластиды представляют собой целостную группу организмов, характеризующуюся своеобразным планом строения, главным признаком которого является наличие в их клетках кинетопласта (Honig- berg, 1963; Vickerman, Preston, 1976; Фролов, 1993; Frolov, Karpov, 1995).Светооптическое описание морфологии
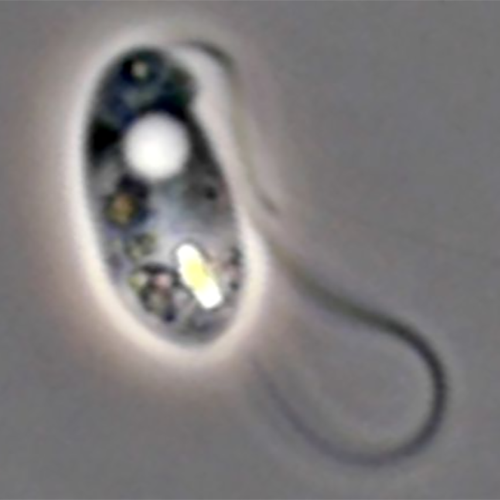
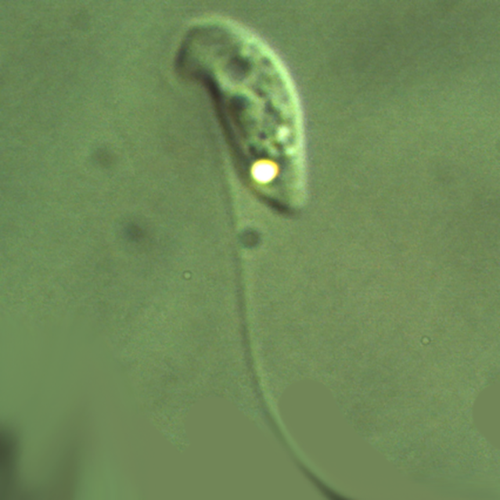
Морфология двухжгутиковых кинетопластид, как свободноживущих, так и паразитических, не отличается заметным разнообразием. При изучении жгутиконосцев in vivo или на окрашенных препаратах удается наблюдать основные клеточные структуры: жгутики, кинетопласт, ядро, цитостом, сократительную и пищеварительные вакуоли. Количественные и качественные характеристики этих признаков лежат в основе систематики бодонид и криптобий. Свободноживущие кинетопластиды формируют относительно мономорфные популяции. Жизненные циклы паразитических криптобий могут протекать с более или менее выраженным чередованием стадий. Как правило, это сопровождается появлением различных (2 и более) морфологических форм жгутиконосцев. Однако различия между ними невелики и касаются лишь формы и размеров их тела (Lorn, 1979).По ходу реализации своих жизненных циклов трипаносоматиды на фоне чередования стадий развития проходят и через смену ряда морфологических форм клеток.
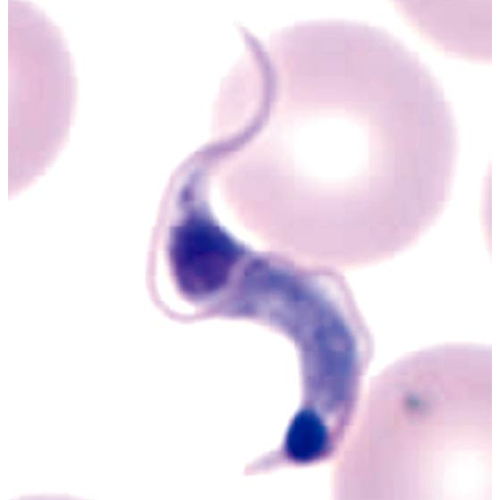
Сочетание окраски сухих мазков по Лейшману или по Романовскому—Гимза с наблюдением результата в световом микроскопе представляет собой основной метод исследования морфологии трипаносоматид, на котором базируется классификация их морфологических форм (Ноаге, Wallace, 1966). На окрашенных препаратах можно наблюдать форму тела жгутиконосцев, расположение жгутикового кармана (место выхода жгутика из тела клетки), сам жгутик, ядро и кинетопласт. Именно на основании анализа этих признаков и строится классификация морфологических форм трипаносоматид.
Долгое время большинством исследователей признавалось, что отдельные морфологические формы трипаносоматид характерны для определенных родов этих жгутиконосцев, что служило основанием для их обозначения. Выделяли 4 такие формы: лептомонадную, критидиальную, трипаносомную и лейшманиальную. Их отождествляли со стадиями развития жгутиконосцев, добавляя в ряде случаев к их перечню стадию цисты. Однако в большинстве ранних работ «цисты» гомоксенных трипаносоматид именуются лейшманиальными формами. По мере накопления знаний о строении клеток трипаносоматид, структуре их жизненных циклов и совершенствования системы семейства недостатки этой классификации становились все более очевидными. Так, в частности, оказалось, что клетки трипаносоматид, имеющие кинетопласт в задней позиции, представлены 2 различными морфологическими формами (описто- и трипомастиготы), «лептомонадные» и «лейшманиальные» стадии были описаны у представителей большинства родов трипаносоматид, а использование термина «критидиальные формы» потеряло всякий смысл после описания рода Blastocrithidia, к которому были отнесены гомоксенные жгутиконосцы с «критидиальной» организацией(Laird, 1959; Wallace, 1966).
В 1966 г. Гоаром и Уоллесом была предложена новая схема классификации морфологических форм трипаносоматид. Почти за три десятилетия своего существования она практически не претерпела изменений.
Ниже мы приводим названия морфологических форм трипаносоматид по Гоару и Уоллесу (Ноаге, Wallace, 1966), сопровождая их краткой характеристикой.
Промастигота (promastigote) — «лептомонадная форма»; обладает удлиненной формой тела, кинетопласт лежит перед ядром, жгутиковый карман открывается терминально.
Эпимастигота (epimastigote) — «критидиальная форма»; форма тела обычно удлиненная, кинетопласт располагается вблизи ядра, но не заходит за его задний край, жгутиковый карман открывается на латеральной поверхности тела, жгутик подходит к переднему концу клетки, прилегая к ее поверхности и формируя ундулирующую мембрану.
Опистомастигота (opisthomastigote) — «трипаносомная, или трипаноморфная, форма»; встречается только у представителей рода Herpetomonas. Клетки характеризуются удлиненной формой тела, кинетопластом, располагающимся за ядром, и соответственно длинным жгутиковым карманом, открывающимся терминально.
Трипомастигота (trypomastigote) — «трипаносомная форма»; форма тела обычно удлиненная, кинетопласт располагается за ядром, жгутиковый карман короткий, открывается на латеральной поверхности тела. Жгутик прилегает к поверхности клетки, формируя. ундулирующую мембрану.
Хоаномастигота (choanomastigote) — клетки имеют форму кувшинчиков, жгутиковый карман короткий и широкий, открывается терминально, ядро и кинетопласт часто сближены.
Сферомастигота (spheromastigote) — клетки округлой формы, с небольшим свободным жгутиком. Переходная форма между амастиготами и мастиготами.
Амастигота (amastigote) — «лейшманиальная форма»; мелкие клетки трипаносоматид округлой или эллипсоидальной формы, лишенные свободного жгутика.
Следует заметить, однако, что и этот вариант классификации морфологических форм трипаносоматид оказался не лишен противоречий. Так, в группу амастигот, известную с начала века под названием «лейшманиальные формы», объединяются все формы жгутиконосцев, которые под световым микроскопом сходны с «амастиготами» лейшманий. Амастиготами называют внутриклеточные и (или) внутритканевые формы Leishmaniaи Trypanosoma cruzi и цистоподобные формы Leptomonas и Blastocrithidia, а также любые мелкие округлые или эллипсоидальные формы других жгутиконосцев, лишенные как минимум свободной части жгутика. Однако электронно-микроскопические исследования последних десятилетий показали, что на самом деле амастиготы представляют собой гетероморфную группу. Оказалось, что «амастиготы» трипаносом и лейшманий имеют жгутик, целиком помещающийся в жгутиковом кармане. Сходные формы найдены у Herpetomonas и Wallaceina — паразитов насекомых. В то же время «цисты» Leptomonas и Blastocrithidia полностью лишены жгутиков и даже кинетосом. Это противоречие было устранено (Фролов, 1994) после введения в исходную схему еще одной формы — эндомастиготы и уточнения диагноза собственно амастигот: амастиготы (amastigote) — клетки трипаносоматид, лишенные жгутика; эндомастиготы (endomastigote) — клетки трипаносоматид, обладающие жгутиком, который не выходит за пределы жгутикового кармана.
Электронно-микроскопическое описание морфологии
Несмотря на видимые различия в ультратонкой организации клеток бодонид, криптобий и трипаносоматид, именно этот метод позволил убедительно продемонстрировать наличие у них единого плана строения и объединить столь разных на первый взгляд жгутиконосцев в один таксон.Покровы. Покровы кинетопластид, как правило, представлены тубулеммой (Карпов, 1990), т. е. включают плазмалемму и подстилающие ее продольно ориентированные субмембранные микротрубочки. Кроме того, на внешней поверхности плазмалеммы жгутиконосцев часто выявляется гликопротеиновый надмембранный комплекс (Vickerman, Preston, 1976).
Традиционно наличие развитого слоя гликокаликса, покрывающего тело жгутиконосцев, связывается с представителями кинетопластид, которые ведут паразитический образ жизни (Vickerman, Preston, 1976). Более того, до недавнего времени эту особенность организации покровов кинетопластид рассматривали исключительно с точки зрения адаптации их представителей к кровепаразитизму. Однако недавно глико- каликс был описан Бружеролем (Brugerolle, 1985) и Мыльниковым (1986) у бодонид из рода Rhynchobodo. У этих жгутиконосцев мощный слой гликокаликса, достигающий 30 нм толщины, покрывает всю поверхность их тела, выстилает жгутиковый карман и переходит на плазмалемму свободной части жгутиков.
В другой группе двухжгутиковых кинетопластид — у криптобий — в различной степени развитый гликокаликс оказался обычным атрибутом наружной поверхности плазмалеммы. Причем отмечен он и у кровепаразитов, и у жгутиконосцев, которые паразитируют в других органах хозяев. У ряда видов, например у Cryptobia salmositica, надмембранный комплекс достигает толщины 30 нм и покрывает всю поверхность клетки, жгутиковый карман и жгутики. У эндопаразитов, подобных С. vaginalis, напротив, гликокаликс располагается на поверхности клеток жгутиконосцев нерегулярно и не достигает высокой степени развития.
У трипаносоматид наличие выраженного слоя поверхностных гликопротеинов характерно в первую очередь для кровяных стадий трипаносом. Особенно мощного развития достигает гликокаликс, формирующийся на поверхности клеток кровяных стадий африканских трипаносом млекопитающих. Эти трипаносомы имеют мощный надмембранный комплекс, достигающий толщины 15 нм и более. Однако применение методов электронно-микроскопической цитохимии позволило продемонстрировать наличие гликопротеиновой «шубы» как у большинства других трипаносом, так и у лейшманий и даже у гомоксенных трипаносоматид. Известно, что, покрывая поверхность клеток трипаносоматид, паразитирующих в крови позвоночных животных, гликокаликс обеспечивает защиту транспортных систем плазмалеммы и поверхностных рецепторов от атак антител хозяина. В этой связи интересны факты обнаружения развитого гликокаликса на поверхности клеток так называемых низших трипаносоматид — паразитов кишечного тракта насекомых. Так, у эндомастигот жгутиконосцев рода Wallaceina плазмалемму покрывает мощный слой структурированного гликокаликса, более напоминающий надмембранные комплексы ряда ризопод. Жгутиконосцы Phytomonas serpens обладают развитым гликокаликсом и при этом, подобно кровяным трипаносомам, при чередовании стадий по ходу жизненного цикла сначала полностью освобождаются от гликопротеиновой шубы, а затем вновь ее приобретают.
У свободноживущих бодонид (Bodo, Rhynchobodo, Rhynchomonas) покровы представлены чередующимися участками плазмалеммы и тубулеммы. Замкнутое кольцо субмембранных микротрубочек отмечено в отдельных участках тела только у Rhynchobodo. Обычно под плазмалеммой у бодонид выявляются 2—3 группы микротрубочек. Ленты дорсальных и вентральных микротрубочек закладываются у кинетосом жгутиков в виде одноименных кинетосомальных корешков, третья — s-образная группа микротрубочек в своем происхождении связана с элементами цитостом-цитофарингеального комплекса. Наиболее развитые участки тубулеммы обнаруживаются на переднем конце клеток жгутиконосцев. У большинства видов свободноживущих бодонид здесь представлены микротрубочки всех трех групп. Наиболее многочисленны микротрубочки, армирующие дорсальную поверхность клетки, — это микротрубочки дорсальной группы и ФАС. Количество вентральных субмембранных микротрубочек обычно не превышает 4—5. Микротрубочки цитостомальной группы ФАС подстилают плазмалемму на незначительном протяжении и в посторальной области тела погружаются в глубь цитоплазмы. У ряда видов бодонид основные ленты субмембранных микротрубочек — дорсальная и вентральная могут быть очень короткими, и тогда покровы жгутиконосцев на большем своем протяжении формируются за счет простой, неармированной плазмалеммы. Покровы представителей другой группы двухжгутиковых кинетопластид — криптобий, с одной стороны, очень близки к покровам свободноживущих бодонид. Так, у Cryptobia intestinalis в формировании тубулеммы принимают участие все 3 перечисленные выше группы микротрубочек. С другой стороны, большинство криптобий, например С. branchialis, С. helicis, C.jubilans, С. vaginalis, и все кровепаразиты утрачивают s-образную группу микротрубочек, при этом у них резко возрастает число вентральных субмембранных микротрубочек. Тубулемма этих жгутиконосцев формируется за счет двух лент микротрубочек — дорсальной и вентральной, разделенных участками неармированной плазмалеммы. У С. borreli, С. helicis, С. salmositica число дорсальных субмембранных микротрубочек прогрессивно возрастает по направлению к заднему концу клетки. При этом в посторальной части тела этих жгутиконосцев обе ленты смыкаются, формируя тубулемму с единственной брешью, где в субмембранной зоне часто располагаются гребни гладкого ЭПР.
Ни на одной из стадий жизненного цикла покровы трипаносоматид не бывают представлены одной лишь плазмалеммой. Для многих видов трипаносоматид (все «низшие трипаносоматиды» и Leishmania) характерен цельный, замкнутый ряд субмембранных микротрубочек. Только у трипаносом в этом ряду имеется брешь. Подобно криптобиям, у трипаносом в эту брешь заходят гребни ЭПР. Субмембранные микротрубочки трипаносоматид закладываются как единая группа в электронно-плотном материале, подстилающем плазмалемму апикальной части жгутикового кармана.
Все разнообразие в организации покровов кинетопластид может быть представлено в виде эволюционного ряда, отражающего степень развития тубулеммы. Полярные позиции в этом ряду занимают покровы некоторых свободноживущих бодонид, представленные на значительном своем протяжении неармированной плазмалеммой, и целостная тубулемма большинства трипаносоматид. Промежуточное положение в этом ряду занимают покровы криптобий. Для большинства из них характерно наличие сегментированной тубулеммы, которая формируется за счет 2 (иногда 3) групп субмембранных микротрубочек: дорсальной и вентральной. Вместе с тем некоторые криптобии демонстрируют тенденцию к формированию хотя и неполного, но единого ряда субмембранных микротрубочек. Подобная тубулемма, характеризующаяся наличием единственной бреши в ряду субмембранных микротрубочек, встречается только у трипаносом, которые по этому признаку занимают промежуточное положение между криптобиями и остальными трипаносоматидами.
Особо следует остановиться на покровах расселительных стадий кинетопластид, приспособленных для переживания неблагоприятных условий окружающей среды. Такие стадии описаны у свободноживущих бодонид и у паразитических гомоксенных трипаносоматид из насекомых. Известно, что некоторые виды свободноживущих бодонид могут образовывать настоящие цисты. У свободноживущих гетеротрофных бодонид процесс инцистирования связан с формированием внеклеточной оболочки — стенки цисты. Защитная оболочка формируется над плазматической мембраной. Жгутиконосцы втягивают жгутики внутрь клетки и округляются. Никаких существенных изменений в морфологии субмембранной зоны у инцистированных особей жгутиконосцев выявить не удается.
Основным элементом поверхностных структур цистоподобных расселительных стадий низших трипаносоматид, который непосредственно граничит с окружающей средой, является плазмалемма. У некоторых видов трипаносоматид на поверхности плазмалеммы цистоподобных стадий может присутствовать в той или иной степени выраженный слой гликокаликса. Специфической чертой организации этих стадий, кроме того, является наличие слоя специализированной субмембранной цитоплазмы, в которую погружаются субмембранные микротрубочки.
Жгутики. Жгутики кинетопластид представляют собой покрытые плазмалеммой цитоплазматические выросты, отходящие от дна перманентной инвагинации, формирующейся на теле жгутиконосцев, которая получила название жгутикового кармана. Все свободноживущие бодониды и все криптобии имеют по 2 гетеродинамных жгутика, а все трипаносоматиды — 1 направленный вперед двигательный жгутик. Передние жгутики бодонид и криптобий свободные. Направленные назад рекуррентные жгутики бодонид свободные, в то время как у криптобий рекуррентные жгутики плотно прилегают к поверхности тела жгутиконосцев. В процессе движения жгутиконосцев участок тела, прилегающий к рекуррентному жгутику, в ответ на его изгибания периодически вытягивается в уплощенную складку — ундулирующую мембрану, которая хорошо видна даже под световым микроскопом. Единственный жгутик трипаносоматид может либо быть свободным (это характерно для видов, жгутиковый карман которых открывается на апикальном конце клетки), либо, подобно рекуррентному жгутику криптобий, прилегать к телу клетки (если жгутиковый карман открывается на латеральной ее поверхности). В последнем случае также формируется ундулирующая мембрана, причем в зоне контакта плазмалеммы жгутика и тела простейшего у трипаносоматид обнаруживаются множественные точечные десмосомы.
Тонкое строение жгутика кинетопластид в целом типично. В нем можно выделить 3 отдела: кинетосому, переходную зону и собственно свободную часть жгутика.
В неделящихся клетках кинетопластид обнаруживаются 2 кинетосомы. Обычно они располагаются под произвольным углом друг к другу, но чаще их продольные оси параллельны друг другу. Обе кинетосомы представляют собой цилиндры, стенки которых сформированы за счет 9 триплетов микротрубочек.
У свободноживущих бодонид и у криптобий обе кинетосомы являются «рабочими», т. е. связаны с функционирующими жгутиками: одна — с направленным вперед, двигательным, другая — с рекуррентным. У трипаносоматид одна из кинетосом является «рабочей» — она формирует единственный, направленный вперед двигательный жгутик. Другая в неделящихся клетках не связана со жгутиком. Эту кинетосому называют покоящейся, или сателлитной. Субструктура рабочей и сателлитной кинетосом однотипна. Известно, что при бинарном делении трипаносоматидновый жгутик дочерней особи «отрастает» от сателлитной кинетосомы (Sherwin, Gull, 1989), после чего около рабочих кинетосом закладываются новые сателлиты. У двухжгутиковых кинетопластид в процессе деления обе кинетосомы удваиваются, формируя новые жгутики дочерних особей. Таким образом, в делящихся клетках кинетопластид могут выявляться одновременно 4 кинетосомы.
У свободноживущих бодонид и у криптобий дифференцируются 2 микротрубочковых корешка: один связан с кинетосомой двигательного жгутика, другой — с кинетосомой рекуррентного жгутика. Первый, состоящий из 3—4 микротрубочек, часто связанный в основании с плотной фибриллярной пластинкой, проходит под дорсальной стенкой жгутикового кармана и принимает участие в формировании группы дорсальных субмембранных микротрубочек. Около кинетосомы рекуррентного жгутика закладывается микротрубочковый корешок, связанный с вентральными субмембранными микротрубочками. Обычно он насчитывает всего 2 микротрубочки. Кроме основных микротрубочковых корешков обе кинетосомы обычно формируют короткие фибриллярные шпоры. В районе локализации кинетосом также могут присутствовать отдельные микротрубочки или их небольшие ассоциаты, но их связь с кинетосомами не прослеживается.
Единственный кинетосомальный корешок, состоящий из 3—4 сближенных микротрубочек, найден у всех исследованных видов трипаносоматид. Отходя от основания кинетосомы, он спирально огибает жгутиковый карман, и его микротрубочки проникают в муфту плотного, войлокоподобного материала, окружающего апикальную часть жгутикового кармана. На начальных этапах деления трипаносоматид, еще до закладки новых сателлитных кинетосом, кинетосома отрастающего жгутика (бывшая сателлитная) формирует собственный корешок.
Жгутики кинетопластид характеризуются наличием длинной переходной зоны, существенно выступающей за уровень дна жгутикового кармана. Эта часть жгутикового аппарата имеет типичное для протистов строение и представляет собой цилиндр, стенки которого построены из 9 периферических дублетов микротрубочек. В переходной зоне жгутиков кинетопластид выявляются 2 поперечные структуры, которые обычно называют базальной и терминальной пластинками.
Базальная пластинка чаще всего имеет вид фибриллярной шайбы, наружный диаметр которой соответствует внутреннему диаметру кольца периферических дублетов, а диаметр ее центрального отверстия обычно составляет не менее 50—60 нм.
Терминальная поперечная структура переходной зоны жгутиков свободноживущих бодонид более всего соответствует «поперечной пластинке». Как правило, это диск, диаметр которого близок к внутреннему диаметру кольца периферических дублетов переходной зоны. На верхней поверхности этого диска расположен еще один диск (или валик) меньшего диаметра, который можно рассматривать как аксосому. Иногда такой валик располагается под терминальной пластинкой. В обоих случаях с ним связаны основания одной или обеих микротрубочек центральной пары аксонемы. Однако у некоторых бодонид дополнительные уплотнения на поверхности терминальной пластинки могут отсутствовать. На уровне терминальной пластинки, между периферическими дублетами и плазмалеммой жгутика, у бодонид находится так называемая параксиальная пластинка, от которой берет начало параксиальный тяж. По мере приближения к плазмалемме параксиальная пластинка переходит в массивную фибриллярную структуру. Оба жгутика обращены друг к другу параксиальными пластинками, и их плазмалеммы в этом месте часто плотно прилегают друг к другу.
Терминальная структура переходной зоны жгутиков многих видов криптобий, таких как С. intestina- lis, С. jubilans, С. vaginalis, сходна с аналогичной структурой свободноживущих бодонид. Здесь также имеется параксиальная пластинка, и жгутики взаимодействуют друг с другом аналогичным образом. Однако у целого ряда представителей криптобиид терминальная пластинка в переходной зоне жгутиков отсутствует. Терминальная структура переходной зоны С. helicis, С. borreli, С. salmositiea представлена толстостенным фибриллярным «стаканом», дно которого обращено к устью жгутикового кармана. От стенок этого «стакана» к динеиновым ручкам периферических дублетов переходной зоны отходят лучевидные филаменты. От дна «стакана» берут начало центральные микротрубочки аксонемы, следовательно, есть все основания рассматривать этот элемент как аксосому.
Терминальная структура переходной зоны жгутика трипаносоматид состоит из 2 элементов. Как правило, это хорошо оформленная аксо- сома глобулярного типа и периферический цилиндр или спираль, связанные с А-трубочкамиаксонемы. Параксиальная пластинка у трипаносоматид отсутствует, а параксиальный тяж начинается выше уровня терминальной структуры переходной зоны.
Ундулиподия. На уровне терминальной структуры переходной зоны в жгутиках кинетопластид закладывается центральная пара микротрубочек аксонемы. Аксонема на всем своем протяжении имеет классическое строение 9 + 2. Дистальная часть аксонемы формируется при последовательной утрате центральной пары микротрубочек и замене периферических дублетов на синглеты.
Среди распространенных аберраций аксонемаль- ного комплекса жгутиков кинетопластид можно отметить обнаружение «голой» аксонемы в цитоплазме клеток кинетопластид. Часто удается наблюдать размещение таких «внутриклеточных» аксонем вблизи субмембранных микротрубочек и даже их встраивание в тубулемму. Это явление, вероятно, отчасти объясняется тем, что микротрубочки аксонемы и субмембранные микротрубочки имеют идентичную изоформу а-тубулина, что было показано на примере Trypanosoma brucei (Schneider et al., 1987).
Характерной чертой в организации жгутиков кинетопластид является наличие в них параксиального тяжа — микрофиламентозной структуры со сложной пространственной организацией, ассоциированной с аксонемой. Среди протистов сходные структуры найдены в жгутиках эвгленовых жгутиконосцев, динофлагеллят и у некоторых других протистов (Cachon et al., 1988; Карпов, 1990). Функция параксиальных структур пока неясна. У двухжгутиковых кинетопластид параксиальный тяж является обязательным атрибутом обоих жгутиков. У трипаносоматид параксиальный тяж формируется в жгутиках, выполняющих двигательную функцию, и отсутствует лишь в двигательных жгутиках ряда симбионтсодержащих видов (Freymuller, Camargo, 1981). В жгутиках, выполняющих прикрепительную функцию, эта структура обычно подвергается разборке.
Параксиальный тяж сопровождает аксонему на большем ее протяжении, заканчиваясь несколько ниже того уровня, с которого начинается реорганизация ее дистальной части. Таким образом, кончик жгутика, часто слегка вздутый лишен основных структурных элементов и, вероятно, представляет собой наиболее пластичную его часть. Основными элементами параксиального тяжа трипаносоматид являются микрофиламенты диаметром 7 и 25 нм.
Параксиальный тяж в жгутиках кинетопластид занимает константное положение по отношению к плоскости, проходящей через пару центральных микротрубочек аксонемы, нумерация дублетов которой подчиняется правилу Афцелиуса. В двигательных (передних) жгутиках свободноживущих бодонид и криптобий параксиальный тяж ассоциирован с 4-м и 7-м дублетами аксонемы, а в их рекуррентных жгутиках он морфологически связан либо с 3-м и 6-м, либо с 5-м и 8-м дублетами. В единственном жгутике трипаносоматид параксиальный тяж морфологически связан с 4-м и 7-м дублетами.
Жгутики кинетопластид являются полифункцио- нальными органеллами. Наиболее известным примером этого служит способность паразитических кинетопластид преобразовывать свой жгутик из двигательной органеллы в специализированную органеллу прикрепления. В зависимости от типа субстрата жгутиконосцы используют либо принцип заякрривания (это характерно для жгутиконосцев, которые закрепляются на эпителиях, формирующих микроворсинки), либо принцип присоски — при закреплении на кутикулярных выстилках эпителия. Оба способа прикрепления широко распространены у трипаносоматид, причем у разных стадий одного и того же вида могут использоваться оба способа. У криптобий по типу заякоривания происходит закрепление видоизмененного жгутика Cryptobia sp. на эпителии сперматеки улитки Triadopsis multilineata, a Cryptobia branchialis использует принцип присоски, закрепляясь на эпителии жабр рыб.
Завершая рассмотрение организации двигательного аппарата кинетопластид, можно сделать следующие выводы. По своему строению жгутики кинетопластид образуют очевидный эволюционный морфологический ряд, в котором крайние позиции занимают свободноживущие Bodonidae и Trypanosomatidae, а промежуточную — Cryptobiidae. Со свободноживу- щими бодонидами криптобий сближает наличие 2 гетеродинамных жгутиков, однотипная организация кинетосомальных корешков, наличие параксиальной пластинки, расположение параксиальных тяжей в обоих жгутиках и формирование межжгутиковых контактов на уровне дистальной части переходных зон. Криптобий и трипаносоматид сближает отсутствие в переходных зонах их жгутиков терминальной пластинки, наличие обособленной аксосомы, способность к трансформации двигательных жгутиков в органы прикрепления. Наличие единственного 3 или 4 микротрубочкового кинетосомального корешка, ассоциированного с субмембранными микротрубочками, и жесткая связь параксиального тяжа с 4-м и 7-м дублетами аксонемы позволяют рассматривать единственный жгутик трипаносоматид и двигательные (передние) жгутики бодонид и криптобий как гомологичные структуры.
Ротовой аппарат. Потребление питательных веществ клетками кинетопластид может происходить различными способами (Vickerman, Preston, 1976). У многих кинетопластид этим целям служат, в частности, специализированные клеточные структуры, формирующие сложные цитостом-цитофарингеаль- ные комплексы. В настоящее время такие комплексы описаны у всех изученных представителей свободноживущих бодонид, криптобий и у многих трипаносоматид. Только среди трипаносоматид имеются жгутиконосцы, у которых ротовой аппарат полностью редуцирован. Среди них — все представители африканских трипаносом группы Salivaria, Leishmania и Endotrypanum, Phytomonas, гомоксенные Blastocrithidia и часть Leptomonas.
Среди всего многообразия цитостомцитофарингеальных комплексов кинетопластид мы выделяем 2 основные их формы: полные и редуцированные комплексы. Последние отличаются частичной утратой ряда элементов комплекса, и в первую очередь отсутствием выраженной клеточной глотки.
Наиболее развиты и сложно организованы полные цитостом-цитофарингеальные комплексы свободноживущих бодонид. У этих жгутиконосцев они приспособлены для заглатывания крупных пищевых частиц, например бактерий. Наружный диаметр цитостома бодонид часто равен диаметру наружного отверстия жгутикового кармана или превышает его. Плазмалемма цитостома подстилается плотным войлокоподобным материалом, который обычно имеет сложную пространственную организацию и с которым связаны основания 4—5 групп микротрубочек. Общими для всех изученных видов бодонид являются 2 основные ленты микротрубочек, одна из которых (мтр) закладывается в плотном материале у стенки жгутикового кармана, другая (фас) — в аналогичном материале у стенки цитостомальной воронки. 5—6 микротрубочек группы мтр по восходящей спирали армируют стенку жгутикового кармана, проникают в цитоплазму переднего конца клетки, где делают поворот на 180° и затем армируют последовательно стенку цитостомальной воронки и цитофаринкс. Отличительной чертой этой группы является связь ее микротрубочек с плазмалеммой жгутикового кармана, цитостома и частично цитофаринкса посредством электронноплотных «бляшек». Группа микротрубочек фас закладывается в плотном материале под плазмалеммой цитостома. Эта лента по широкой спирали окружает воронку цитостома и проксимальную часть цитофаринкса и уходит в глубь клетки. Часто, на значительном протяжении эта лента микротрубочек располагается в субмембранной зоне жгутиконосцев. В массивах плотного материала, подстилающего плазмалемму цитостома, берут начало 4—5 цмт, которые закладываются по отдельности и не формируют компактную ленту, цмт армируют стенки цитостома и цитофаринкса вместе с микротрубочками группы мтр. Кроме перечисленных элементов в формировании цитоскелета цитостомального комплекса ряда свободноживущих бодонид принимают участие так называемые микротрубочковые призмы. Это компактные группы, насчитывающие по 10—20 и более микротрубочек, которые берут начало в плотном материале у дна цитостома. Взаимное расположение микротрубочек таково, что на поперечном срезе призмы их профили образуют правильный треугольник или трапецию. Микротрубочки в призме связаны друг с другом мостиками. Мик- ротрубочковая призма сопровождает цитофаринкс на всем его протяжении. Однако непосредственной связи между этими структурами нет, и функции таких призм пока неясны.
У криптобий цитостом-цитофарингеальные комплексы организованы так же, как у свободноживущих бодонид. Наиболее близка к бодонидному типу организация цитостом-цитофарингеального комплекса Cryptobia intestinalis. Цитоскелет хорошо развитого орального аппарата этого жгутиконосца включает все 3 основные группы микротрубочек: мтр, фас и цмт. Кроме того, цитостом и цитофаринкс С. intestinalis окружены мощной фибриллярной муфтой, имеющей периодическую исчерченность. У большинства других криптобий цитостом-цитофарингеальные комплексы по сравнению с бодонида- ми как бы миниатюризованы. Цитостом открывается на вентральной поверхности тела жгутиконосцев. Его наружный диаметр несколько меньше диаметра жгутикового кармана. От дна цитостомальной воронки отходит трубчатый цитофаринкс. Его диаметр существенно меньше, чем у бодонид. Армирующие клеточную глотку микротрубочки имеют двоякое происхождение. 5—6 микротрубочек группы мтр прослеживаются от стенки жгутикового кармана, с которой каждая из них связана бляшками плотного войлокоподобного материала. Достигая вентральной поверхности тела жгутиконосца, они поворачивают на 180°, локализуясь в гребневидном выпячивании тела жгутиконосца. Так же, как и у стенки жгутикового кармана, плотные бляшки соединяют их здесь с плазмалеммой гребня. Внутри гребня эти микротрубочки сопровождают 2 пластинки, расположенные по обе стороны от ленты. Они состоят из плотного, войлокоподобного материала и ассоциированы с 2—3 дополнительными микротрубочками, представляющими группу смт. Достигая отверстия цитостома, оральный гребень встраивается в его стенку. Теперь микротрубочки группы мтр и цмт армируют цитостомальную воронку и далее — канал цитофаринкса. Ближе к центру клетки часть этих микротрубочек исчезает, и здесь цитофаринкс армируется всего 3—5 микротрубочками.
Среди трипаносоматид полный цитостом-цитофа- рингеальный комплекс известен у трипаносом, паразитирующих в крови рыб, у Shisotrypanum и одного представителя «низших» гомоксенных трипаносоматид — Leptomonas nabicula.
Хорошо развитый воронковидный цитостом Trypanosoma danilewskyi открывается на поверхности тела за пределами жгутикового кармана, вблизи места контакта жгутика с телом клетки. Цитостом имеет наружный диаметр 150—200 нм. От дна цитостома в глубь клетки отходит цитофаринкс. Клеточная глотка Т. danilewskyi армируется 6 — 7 микротрубочками. 4 из этих микротрубочек закладываются у стенки жгутикового кармана и связаны с его плазмалеммой электронноплотными бляшками. Эти микротрубочки, несомненно гомологичные микротрубочкам группы мтр двухжгутиковых кинетопластид, армируют стенку жгутикового кармана трипаносом, а достигнув поверхности тела, поворачивают на 180° и подстилают плазмалемму цитостома и цитофаринкса. Еще 2—3 микротрубочки, соответствующие микротрубочкам цмт, закладываются в слое электронно-плотного материала, подстилающего плазмалемму дна цитостома.
Полные цитостом-цитофарингеальные комплексы других трипаносом имеют похожую организацию. Различия касаются лишь особенностей локализации цитостома и числа микротрубочек в глоточной группе.
Редуцированные цитостом-цитофарингеальные комплексы обнаружены у трипаносом, паразитирующих в крови амфибий, и у ряда трипаносом из млекопитающих, а также у многих «низших» трипаносоматид.
У Т. rotatorium отверстие цитостома располагается вблизи внешней границы жгутикового кармана и либо смещено на наружную поверхность тела, либо локализуется в стенке резервуара. Такая нестабильность в локализации цитостома, вероятно, может рассматриваться как иллюстрация возможного пути возникновения в эволюции кинетопластид «скрытого» цитостома. Цитостом Т. rotatorium представляет собой .инвагинацию плазмалеммы, наружный диаметр и глубина которой у разных особей могут варьировать от 100 до 200 нм. Плотный войлокоподобный материал подстилает плазмалемму апикальной части жгутикового кармана и цитостома. С этим материалом связаны 4 микротрубочки, которые соответствуют микротрубочкам группы мтр других кинетопластид. Они закладываются у стенки жгутикового кармана и, достигнув цитостома, направляются в глубь цитоплазмы параллельно его центральной оси. Еще 1—2 микротрубочки группы цмт закладываются в массиве плотного материала у дна цитостома. В результате формируется подобие воронки, горловина которой образована муфтой плотного войлокоподобного материала, заходящего за уровень дна цитостома, а ее расширенная часть представлена конусом из 5—6 микротрубочек. Вдоль микротрубочек осуществляется направленный транспорт пиноцитозных пузырьков в глубь клетки. Такого типа редуцированные цитостомцитофарингеальные комплексы достаточно широко распространены у трипаносом. Строение их очень похоже, а различия носят частный характер, касаясь главным образом числа микротрубочек в глоточной группе.
Среди «низших» трипаносоматид редуцированные цитостом-цитофарингеальные комплексы обнаружены у всех изученных представителей родов Crithidia, Herpetomonas, Wallaceina, а также у некоторых Leptomonas. Наличие редуцированного цитостома в клетках трипаносоматид легко выявляется на электронограммах по присутствию в районе стенки жгутикового кармана дополнительной (помимо 4 микротрубочек дорсального корешка) группы микротрубочек. В отличие от трипаносом цитостом гомоксенных трипаносоматид всегда локализуется в стенке жгутикового кармана. Плотный войлокоподобный материал, окружающий цитостом этих жгутиконосцев, формирует валик, по толщине превышающий слой аналогичного материала, подстилающего стенку жгутикового кармана, производным которого он и является. Этот валик, полукольцом охватывающий цитостомальную воронку, а точнее, ямку, часто имеет форму запятой. У его расширенной части в плотном материале, подстилающем стенку жгутикового кармана, закладывается 5—8 микротрубочек, формирующих компактную ленту. С противоположной стороны цитостома, несколько ближе к заднему концу клетки, подобным образом закладывается 1—2 микротрубочки. Объединяясь, обе группы формируют «глоточный желоб», с которым связаны начальные этапы транспортировки пиноцитозных пузырьков, формирующихся у дна цитостомальной ямки. Мик- ротрубочковый «желоб», вероятно, является функциональным аналогом клеточной глотки, а точнее, ее рудиментом, поскольку в его формировании принимает участие часть элементов, которые имеются в полном цитостом-цитофарингеальном комплексе. Организация редуцированных цитостомальных комплексов различается у отдельных представителей го- моксенных трипаносоматид лишь по наборам микротрубочек в глоточной группе. Так, у Herpetomonas muscarum количество микротрубочек в глоточной группе достигает ГО, а у Wallaceina brevicula их 8.
Поскольку цитостом-цитофарингеальные комплексы кинетопластид, как свободноживущих, так и паразитических видов, являются гомологичными структурами, все их многообразие может быть представлено в виде эволюционного ряда. Очевидно, что первую позицию в этом ряду следует отвести цитостом-цитофарингеальным комплексам свободноживущих гетеротрофных бодонид, поскольку организация трипаносоматид и криптобий так или иначе связана с вторичной адаптацией их представителей к паразитическому образу жизни. Следующую позицию в этом ряду занимают цитостомаль- ные аппараты криптобий. У Cryptobia intestinalis сохраняется типичный «бодонидный» тип строения этого комплекса, однако большинство криптобий утрачивают одну из основных групп микротрубочек, армирующих цитофаринкс бодонид, — фас микротрубочки. Собственно, именно такой тип цитостом- цитофарингеального комплекса формируется и у трипаносом, паразитирующих в крови рыб. У криптобий и трипаносом наблюдается пространственная разобщенность цитостома и жгутикового кармана и наличие только 2 групп микротрубочек, армирующих стенки комплекса. В организации ротовых аппаратов остальных трипаносоматид ясно прослеживаются 2 основные эволюционные тенденции: смещение отверстия цитостома с наружной поверхности тела на стенку жгутикового кармана и последовательная редукция всего комплекса вплоть до полной его утраты рядом трипаносом, лейшманий и гомок- сенных «низших» трипаносоматид.
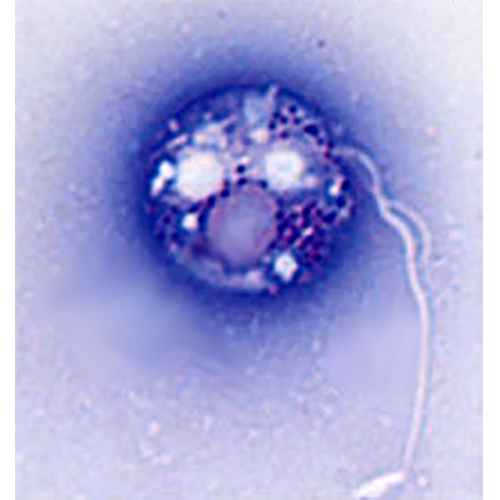
Кинетопласт — митохондрион. Уникальным признаком в организации кинетопластид является наличие в их клетке единственной гигантской митохондрии со специализированным ДНК-содержащим участком — кинетопластом. У некоторых кинетопластид митохондрия может иметь простую форму удлиненного эллипсоида, однако чаще мито- хондрион представлен сетью кольцевых и продольных рукавов, которые могут ветвиться и анастомозировать друг с другом. Митохондрйон кинетопластид можно наблюдать в световом микроскопе, используя методы специфического окрашивания митохондриальных ферментов (например, тетранитроголубым тетразолием) или применяя флюоресцентные красители типа родамина 123.
Как и у большинства других эукариот, внутренняя мембрана митохондрий кинетопластид формирует особые складки — кристы. Как правила, морфология митохондриальных крист протистов высоко консервативна и в ряде случаев характеризует рамки таксонов высокого ранга (Taylor, 1978; Серавин, 1980; Старобогатов, 1986; Карпов, 1990). Считается, что для кинетопластид характерно наличие пластинчатых тарелковидных крист в митохондриях. Однако некоторые виды кинетопластид демонстрируют уникальные примеры диморфизма митохондриальных крист. Так, наряду с типичными тарелковидными кристами в митохондрии С. borreli часто обнаруживаются ворсинчатые (длинные трубчатые) кристы. У С. jubilans в митохондрии обнаружены ампуловидные кристы, которые можно отнести также к типу трубчатых крист. У трипаносоматиды Crithidia fasciculata в митохондрии обнаружены 2 типа крист: тарелковидные и ворсинчатые; аналогичные кристы обнаружены и у Wallaceina brevicula. У африканских трипаносом в ходе клеточной дифференцировки происходит регулярное чередование тарелковидных и ворсинчатых крист, сопровождающееся изменением типа метаболизма клеток. 2 типа крист обнаруживаются в митохондриях Trypanosoma danilewskyi. Изменение морфологии митохондриальных крист можно наблюдать при инцистировании некоторых свободноживущих бодонид.
Трансформация митохондрий кинетопластид в ходе цитокинеза изучена пока очень слабо. Нераз- ветвленная; палочковидная митохондрия кровяных стадий африканских трипаносом удваивается путем простого продольного деления. Вероятно, подобным образом происходит деление слабо ветвящихся митохондрий большинства двухжгутиковых кинетопластид. Что же касается ретикулярного митохонд- риона трипаносоматид, то его преобразование в ходе цитокинеза обычно связывают с появлением так называемых лабиринтовидных митохондрий. Их особенность заключается в том, что митохондриальный матрикс на этой стадии оказывается пронизан множеством каналов, содержащих цистерны ЭПР. Однако сам механизм удвоения ретикулярного митохонд- риона пока не прослежен.
Кинетопласт представляет собой расширенный участок митохондриона, располагающийся у основания кинетосом жгутиков, в котором сосредоточена вся или почти вся митохондреалъдая ДНК. Кинетопласт стал известенгши- рокому кругу исследователей вслед за введением в лабораторную практику окраски по Романовскому— Гимза. Первая догадка о природе кинетопласта и введение этого термина в научную литературу принадлежат Алексееву (1917). Интересно, что его предположения были подтверждены лишь через полвека, когда удалось увидеть кинетопласт в электронном микроскопе (Clark, Wallace, 1960; Steinert, 1960).
Митохондриальную ДНК, сосредоточенную в ки- нетопласте, называют кинетопластной ДНК (кДЙК). В клетках трипаносоматид на ее долю приходится до 20% общего количества ДНК. Переплетающиеся кольца кДНК формируют нуклеоид, который располагается в мешковидном вздутии митохондриона— капсуле кинетопласта. У бодонид и криптобий она ориентирована параллельно продольной оси клетки и представляет собой дистальную часть колбасовидного митохондриона, а у трипаносоматид капсула кинетопласта чаще располагается поперек клетки и в ретикулярных митохонд- рионах обычно представляет собой мешковидный анастомоз, соединяющий латеральные рукава митохондрии.
Викерман (Vickerman, 1977) выделяет 3 основные морфологические формы кинетопластов: панки- нетопласты, поликинетопласты и эукинетопласты. В панкинетопластах фибриллы кДНК располагаются более или менее диффузно в митохондриальном матриксе, капсула кинетопласта практически не выражена. Вероятно, это наиболее примитивная форма кинетопластии, встречающаяся у свободноживущих бодонид и ряда криптобий. При поликинетопластии кДНК образует несколько хорошо дифференцируемых скоплений, часто приуроченных к локальным вздутиям митохондрии. Поликинетоплас- тия может сочетаться с панкинетопластией при чередовании стадий развития ряда бодонид и криптобий. Эукинетопласты известны у представителей всех 3 групп кинетопластид. В данном случае кДНК собрана в одном, специализированном участке митохондриона, расположенном у основания кинетосом жгутиков. У трипаносоматид известна только эта форма организации кинетопластов (Каллиникова, 1977). Однако если эукинетопласты свободноживущих бодонид и криптобий в большинстве своем морфологически сходны, то морфология кинетопластов трипаносоматид практически не имеет аналогов среди других кинетопластид. Она характеризуется компактной упаковкой колец кДНК, при которой нуклеоид в форме слегка вогнутого диска располагается обычно в центре капсулы, имеющей сходную форму. У трипаносоматид известны случаи полной утраты оформленного нуклеоида (при сохранении капсулы кинетопласта). Это явление получило название акинетопластии, или, что более корректно, дискинетопластии. Спонтанная дискинетопластия встречается у многих трипаносоматид. Однако жизнеспособные дискинетоп- ластные штаммы могут формироваться только в популяциях африканских трипаносом. Наиболее характерно это явление для трипаносом из подрода Trypanozoon. У Т. evansi и Т. equiperdum существуют как природные дискинетопластные штаммы, так и штаммы, полученные в лабораторных условиях. Структура нуклеоида изучена пока только у трипаносоматид, у которых он формируется за счет компактной упаковки мини- и максикольцевых молекул кДНК. Первых насчитывается десятки тысяч, вторых — сотни на кинетопласт. Размеры мини- и максикольцевых молекул достаточно специфичны на уровне групп видов, иногда видов трипаносоматид.
Ядро. Интерфазные ядра. Интерфазные ядра бодонид, криптобий и трипаносоматид имеют во многом сходную организацию. В центре ядра или несколько в стороне от него расположено ядрышко. Наиболее характерной чертой интерфазных ядер кинетопластид является конденсированный гетерохроматин, основная масса которого располагается по периферии ядра, прилегая к внутренней поверхности ядерной оболочки. Помимо пристеночных массивов гетерохроматин встречается в кариоплазме в виде отдельных глыбок. У бодонид гетерохроматин иногда представлен несколькими плотными тяжами. Подобная организация ядра отмечена и у ряда видов криптобий.
Ядра цист и цистоподобных стадий. В клетках инцистированных особей свободноживущих бодонид морфология ядер не претерпевает каких-либо заметных изменений по сравнению с интерфазными ядрами активных жгутиконосцев.
Совершенно особой организацией отличаются ядра цистоподобных амастигот, выполняющих функции расселительных стадий в жизненных циклах го- моксенных трипаносоматид из родов Leptomonas и Blastocrithidia. Их ядра имеют диаметр менее 2 мкм и часто неправильную форму. Характерная черта в организации ядер цистоподобных амастигот — это гиперконденсация хроматина. У всех изученных Blastocrithidia, у Leptomonas oncopel- ti и L. rigidus ядерный хроматин формирует так называемую лабиринтовидную структуру. Основными элементами этой структуры являются тонкие (3—5 нм) фибриллы, которые собираются в тяжи диаметром 20—25 нм. Последние формируют единую извитую ленту, тесно прилегающую к ядерной оболочке и занимающую большую часть внутриядерного пространства.
Хотя ядра предшественников цистоподобных амастигот, уже обладающие лабиринтовидными структурами, продолжают делиться, в них не обнаружены ни характерная для митоза трипаносоматид деконденсация хроматина, ни оформленное микротру- бочковое веретено, так что вопрос о способе деления таких ядер пока остается открытым. В ядрах зрелых, т. е. завершивших все деления, цистоподобных стадий структура конденсированного хроматина не дифференцируется. Различия в организации ядер цист свободноживущих бодонид и цистоподобных стадий трипаносоматид подтверждают, что происхождение этих стадий в обеих группах кинетопластид, вероятнее всего, было независимым.
Митотические ядра. Деление ядер у кинето- пластид протекает по типу закрытых внутриядерных митозов и характеризуется полным отсутствиемспи- рализованных хромосом на всех этапах митоза.
Деление ядра свободноживущего жгутиконосца Boda curvifilus начинается с полной деконденсации массивов пристеночного гетерохроматина. Кариоплазма этих ядер более гомогенная, чем у интерфазных ядер. Ядрышковый материал разрыхляется, существенно увеличиваясь в объеме. На более поздних сроках в ядре формируется микротрубочковое веретено. Микротрубочковое веретено В. curvifilus имеет очевидную биполярную организацию. Центры организации микротрубочек не выражены. В формировании веретена принимают участие полуверетена, закладывающиеся под углом друг к другу. В поздней профазе и ранней метафазе в центре ядра выявляются 2 группы микротрубочек по 13— 15 штук в каждой, располагающиеся под углом друг к другу. В экваториальной плоскости делящегося ядра формируется 10 пар кинетохоров. В начале анафазы ядро принимает эллипсоидальную форму. Веретено вытягивается, большинство микротрубочек простираются между полюсами, которые занимают диаметрально противоположное положение. Кинетохоры начинают двигаться к полюсам делящегося ядра, причем среди них можно выделить 6—7 «быстрых» кинетохоров и 3—4 «медленных». К тому моменту, когда «быстрые» кинетохоры уже практически достигают полюсов, «медленные» проходят всего Ч3 дистанции. Сильно фрагментированный материал ядрышка сосредоточен вокруг центральной части веретена. Однако отдельные его фрагменты обнаруживаются у полюсов ядра вне связи с центральным массивом. На стадии телофазы ядро принимает гантелевидную форму. Кинетохоры исчезают. Некоторое время сохраняется центральная часть веретена, микротрубочки которого располагаются в канале, соединяющем дочерние ядра. В обоих ядрах выявляются компактные ядрышки и пристеночные сгустки конденсированного гетерохроматина. Наконец ядра окончательно обособляются.
Среди криптобий морфология делящихся ядер исследована у Cryptobia borreli (Скарлато, 1987; Скарлато, Лом, 1997). Ранняя профаза характеризуется полной деконденсацией гетерохроматина. Формирующееся затем веретено внутриядерных микротрубочек имеет «рыхлую» структуру. Митотическое веретено представлено 3—4 пучками, содержащими до 40 микротрубочек каждый. С микротрубочками веретена связаны кинетохоры. Пока их число не установлено, однако если судить по косвенным данным, в частности по числу микротрубочек веретена, то. число кинетохоров в ядрах С. borreli должно быть не менее десяти. В телофазе веретено микротрубочек сильно вытягивается и дочерние ядра расходятся, оставаясь соединенными длинным узким каналом, в котором проходят микротрубочки веретена. На этом этапе кинетохоры еще сохраняют связь с веретеном, однако у внутренней мембраны дочерних ядер уже выявляются массивы конденсированного гетерохроматина, сегрегация которого происходит, вероятно, без участия кинетохоров и микротрубочек веретена. В культурах криптобий обнаружены многоядерные клетки, формирование которых предшествует множественному делению жгутиконосцев.
Среди трипаносоматид митоз изучен у относительно небольшого числа видов, представляющих, однако, все основные их группы: гомоксенных «низших» трипаносоматид, трипаносом и лейшманий.
Еще до формирования митотического веретена в ранней профазе в ядрах жгутиконосцев происходит деконденсация гетерохроматина и фрагментация ядрышка. У большинства трипаносоматид ядрышковый материал в дальнейшем тесно прилегает к микротрубочкам веретена и при вытягивании последнего распределяется между дочерними ядрами. Однако у Trypanosoma cruzi описано полное исчезновение ядрышка и формирование ядрышек de novo в каждом из дочерних ядер (Solari, 1980).
Сформированное митотическое веретено в ядрах трипаносоматид имеет хорошо выраженную биполярную организацию, причем у трипаносом бба полюса и центральная часть «экваториальной пластинки» лежат приблизительно в одной плоскости. Однако у лейшманий и «низших» трипаносоматид полуверетена находятся под заметным углом друг к другу вплоть до вытягивания веретена в анафазе—телофазе митоза. Количество микротрубочек, формирующих веретено деления, различается у отдельных представителей семейства. Менее 20 микротрубочек формируется в митотическом веретене некоторых Crithidia. От 20 до 30 микротрубочек имеют в своих митотических веретенах большинство изученных видов гомоксенных трипаносоматид из родов Blastocrithidia и Wallaceina, а также гетероксенные Trypanosoma rho- desiense, Т. danilewskyi, Т. rotatorium и Endotrypa- num sp. Около 60 микротрубочек имеют веретена лейшманий. И наконец, самое развитое митотическое веретено, включающее около 120 микротрубочек, характерно для делящегося ядра Trypanosoma cruzi»
Пространственная организация микротрубочек, формирующих веретено, также различается у отдельных видов трипаносоматид. Условно можно выделить 2 основные формы организации митотического веретена у трипаносоматид — компактную и рыхлую. В первом случае микротрубочки собраны в 1 компактный пучок, во втором формируют 2—3 пространственно разобщенных пучка. У жгутиконосцев с про- мастиготной организацией (у Leishmania, Wallaceina, Crithidia) и у Endotrypanum (в культуре промастигот) митотическое веретено имеет компактный вид, а у жгутиконосцев с эпимастиготной и трипомастигот- ной организацией обнаружены только «рыхлые» веретена. Важная черта организации митотических ядер трипаносоматид — наличие «danse plaques» (кинетохорподобных структур), которые ассоциированы с микротрубочками митотического веретена. Тонкое строение и молекулярная организация этих структур, выясненные в основном благодаря работам Соляри, свидетельствуют о том, что эти структуры гомологичны кинетохорам других эукариот. Число кинетохоров варьирует у различных представителей трипаносоматид: у Trypanosoma cruzi их 10, у Leishmania 6, у Endotrypanum также 6, у Wallaceina 4, у Crithidia fasciculata и Blastocrithidia triatomae 3. Известно, что при митозе эукариот кинетохорам, ассоциированным с отдельными хромосомами и микротрубочками веретена или с ядерной оболочкой, отводится важнейшая роль в сегрегации генома (Райков, 1982). Иными словами, у «нормальных» эукариот число кинетохоров и хромосом одинаково. Однако у трипаносоматид это правило, видимо, нб^Зействует. Морфологически установить взаимосвязь кинетохо- ров и хромосом у этих жгутиконосцев невозможно, так как последние в митозе полностью деспирализо- ваны, т. е. во время деления ядра трипаносоматид к его полюсам расходятся «пустые» кинетохоры. Только связь тонких фибрилл (диаметром около 5 нм) с этими структурами свидетельствует, что по крайней мере часть генома распределяется между дочерними ядрами классическим способом. Различными молекулярно-биологическими методами показано, что реальное количество интактных молекул ДНК или хромосом у трипаносоматид исчисляется десятками и даже сотнями на ядро (Van der Ploeg et al., 1984a, 1984b, 1989; Скарлато и др., 1990). Таким образом, скорее всего, значительная часть генома трипаносоматид распределяется между дочерними ядрами без участия кинетохоров. Возможно, эта роль отводится ядерной оболочке или микротрубочкам веретена. Во всяком случае, число кинетохоров в ядрах трипаносоматид не тождественно числу хромосом и не позволяет судить ни о количестве последних, ни о плоид- ности самих ядер.
Несмотря на то что в представлениях об организации ядерного аппарата кинетопластид еще имеется множество пробелов, некоторые выводы все же можно сделать.
Так, с большой долей уверенности можно говорить о том, что описанная выше форма митоза характерна для кинетопластид в целом. В качестве основных признаков, отличающих митоз кинетопластид, можно перечислить следующие.
1) Ядерная оболочка остается интактной в процессе деления ядра.
2) На ранних этапах митоза происходит полная деконденсация хроматина.
3) ЦОМТы митотического веретена, имеющего биполярную организацию, морфологическими методами не выявляются.
4) Спирализация хромосом не происходит.
5) К полюсам делящегося ядра расходятся кине- тохоры, ассоциированные с микротрубочками веретена. Число кинетохоров прогрессивно убывает в ряду Bodo curvifilus—Cryptobia borreli—Trypanosoma cruzi—Leishmania и Endotrypanum—остальные трипаносоматиды.
Внутриклеточные мембранные системы. К этой группе внутриклеточных структур у протистов обычно причисляют всю совокупность секреторных, экскреторных и транспортных элементов, представленных окруженными цитоплазматическими мембранами каналами, цистернами, вакуолями и пузырьками.
Эндоплазматический ретикулум. Цистерны и каналы ЭПР обоих типов пронизывают всю цитоплазму клеток кинетопластид. Обычно клетки кинетопластид не богаты шероховатым ЭПР. Отдельные фрагменты его каналов чаще сосредоточены возле ядра, где отчетливо выявляется их связь с ядерной оболочкой. Однако у ряда трипаносоматид этот тип ретикулума развит очень хорошо. Так, у некоторых Phytomonas многочисленные каналы шероховатого ЭПР формируют сложный трехмерный многолучевой комплекс. Хорошо развитая система каналов этого типа обнаружена у кровяных стадий Trypanosoma fallisi. В цитоплазме этой трипаносомы шероховатый ЭПР образует значительные по объему скопления параллельно ориентированных каналов, иногда формирующих многорядные концентрические окружности. У этой же трипаносомы отмечена еще одна интересная особенность. Отдельные цистерны шероховатого ЭПР выстраиваются параллельно плаз- малемме, подстилая субмембранные микротрубочки.
Сеть гладкого ЭПР в клетках кинетопластид, как правило, хорошо развита. Его каналы встречаются во всех регионах клетки, однако в двух местах — вблизи комплекса Гольджи и в субмембранной зоне — они особенно многочисленны. У многих трипаносом отмечена приуроченность гребней гладкого ЭПР к субмембранной зоне в месте формирования ундулирующей мембраны. Впервые этот феномен был обнаружен у трипаносом из секции Saliva- ria (Taylor, Godfrey, 1969). Каналы гладкого ЭПР, берущие свое начало от ядерной оболочки, подходят к месту контакта жгутика с телом клетки и формируют комплекс с 3—4 субмембранными микротрубочками по обе стороны от зоны контакта, лишенной микротрубочек. Эти комплексы были названы субпелликулярными органеллами. Позднее аналогичные структуры были описаны под названием гребни ретикулума у большинства трипаносом. Интересно, что у гомоксенных трипаносоматид, обладающих ундулирующей мембраной, эта структура отсутствует, но зато она широко распространена у криптобий. Функции субпелликулярных гребней гладкого ЭПР пока неясны.
Комплекс Гольджи. Аппарат Гольджи у кинетопластид имеет типичное строение. В зоне цитоплазмы, лишенной рибосом, между ядром и кинето- пластом располагаются 3—5, реже до 10 его цистерн, полюса которых окружены многочисленными пузырьками.
Типичным для свободноживущих бодонид следует считать наличие в клетке единственной диктиосомы комплекса Гольджи. Однако у Bodo caudatus в период их инцистирования в клетке обнаруживаются множественные диктиосомы. Сходную полимеризацию диктиосом удается наблюдать у другого представителя двухжгутиковых кинетопластид — Cryptobia salmositica.
У трипаносоматид обычно имеется 1 диктиосома. В этом смысле исключением являются Trypanosoma theileri и Т. fallisi, у которых в клетке бывает 2 и более диктиосомы. У последнего вида несколько диктиосом располагаются вблизи друг от друга. Отмечено формирование ими пузырьков с электронно-плотным содержимым, которые обнаруживаются также в цитоплазме вокруг жгутикового кармана и в его просвете.
С деятельностью аппарата Гольджи традиционно связывают наличие в цитоплазме трипаносоматид мультивезикулярных тел — мембранных мешков, заполненных мелкими, окруженными мембранами пузырьками. Однако их функции и природа пока не изучены. То же самое можно сказать и об акантосо- мах, или «окаймленных пузырьках». Это везикулы диаметром около 50 нм, которые обычно располагаются в пространстве между дном жгутикового кармана и ядром. Окружающая их мембрана несет на своей наружной поверхности сеточку из белка клат- рина. Функции акантосом связывают с транспортам протеинов.
Гликосомы. Одной из характерных черт в организации кинетопластид считается наличие в их цитоплазме электронно-плотных микротелец — гликосом, или пероксисомоподобных органелл (Vickerman, Preston, 1976; Brugerolle et al., 1979). Профили гликосом на электронограммах клеток кинетопластид либо рассредоточены по всей цитоплазме, либо группируются в каком-либо одном месте. Существует точка зрения, что, подобно митохондриону, гликосомы могут формировать в клетке единую ретикулярную структуру. Однако данные по ультратонкой организации трипаносоматид не подтверждают этого. Гликосомы являются органеллами, играющими важную роль в утилизаций глюкозы. В них обнаружены ферменты, участвующие в гликолизе, а также ферменты пиримидинового синтеза.
Сократительная вакуоль. Пульсирующая, или сократительная, вакуоль является еще одним элементом эндомембранной системы. Сократительные вакуоли найдены как у свободноживущих, так и у паразитических кинетопластид. Обычно роль сократительной вакуоли рассматривают в связи с регуляцией осмотического градиента в клетках протистов, однако возможно, что у кинетопластид они могут выполнять и другие функции, в частности экскреторную. Морфология пульсирующих вакуолей и их деятельность изучены пока очень слабо. Интересной особенностью сократительных вакуолей кинетопластид является выведение их содержимого в полость жгутикового кармана, Морфологически система пульсирующей вакуоли включает в себя собственно резервуар вакуоли и всю совокупность ветвящихся приводящих каналов. Последние интересны тем, что их поперечные профили по морфологии и размерам сходны с акантосомами.
Внутриклеточные симбионты. В нутриклеточные симбионты встречаются у протистов довольно часто. Кинетопластиды в этом смысле не являются исключением — прокариотные эндосимбионты описаны у многих видов свободноживущих бодонид и у криптобий. У трипаносоматид эндосимбионты встречаются гораздо реже, чем у двухжгутиковых кинетопластид, однако именно в этой группе эндосимбионты стали объектом специальных исследований, К настоящему времени эндосимбионты описаны у 4 гомоксенных видов трипаносоматид из насекомых — Blastocrithidia culids, Crithidia deanei, C. de- souzai и C. oncopelti, а также у Trypanosoma cobitis из пресноводных рыб и Г. fallisi из амфибий. Взаимоотношение эндосимбионтов с клетками трипаносом пока не изучены. Что же касается трипаносоматид насекомых, то в отношении их эндосимбионтов имеется довольно обширная литература. Исследование их морфологии, а именно организации клеточной стенки и протопласта, показало, что эндосимбионты трипаносоматид являются грамположительными бактериями (Gutteridge, Macadam, 1971). Используя различные антибиотики, удалось получить симбионт- свободные штаммы жгутиконосцев из их исходных, симбионтсодержащих культур (Chang, 1974). Это позволило сравнить метаболизм симбионтсодержащих и «чистых» штаммов жгутиконосцев (Chang, Trager, 1974). В частности, оказалось, что лишенные эндосимбионтов штаммы Blastocrithidia culicis и Crithidia oncopelti являются ауксотрофами по гемину в отличие от исходных геминнезависимых их штаммов. Предполагается, что кроме гемина эндосимбионты могут поставлять в клетки трипаносоматид ряд витаминов и белковых кофакторов. Наличие симбионтов в клетках трипаносоматид существенно сказывается на их морфологии. Так, жгутики симбионтсодержащих особей лишены параксиального тяжа (хотя его специфические белки сохраняются), а ветви митохондриона занимают субмембранную позицию, вклиниваясь между микротрубочками. Однако эти изменения оказываются обратимыми. При удалении симбионтов морфология трипаносоматид приобретает характерные черты: появляется параксиальный тяж, ветви митохондриона рассредоточиваются в цитоплазме (Freymuller, Camargo, 1981). Недавно методом сравнительного сиквенса генов рРНК было показано, что симбионты всех 4 видов гомоксенных трипаносоматид чрезвычайно близки друг другу (более 97 %) и имеют монофилетическое происхождение (Du et al., 1994).
Кроме прокариотных эндосимбионтов в клетках трипаносоматид описаны также вирусоподобные частицы. Однако об их взаимоотношениях с клетками жгутиконосцев практически ничего не известно. Мо- линьо описал вирусоподобные частицы у промасти- гот Leishmania hertigi — кровепаразитов крыс из Панамы. Вирусоподобные частицы размером 50—60 нм находились в цитоплазме промастигот. При трансформации промастигот в амастиготы (при развитии в позвоночном животном) эти частицы переставали выявляться. Через 3—5 дней после того как амастиготы скармливались москитам, в кишечнике последних промастиготы вновь имели в своей цитоплазме вирусные частицы (Molyneux, Ashford, 1983).
ОСОБЕННОСТИ БИОЛОГИИ И ЖИЗНЕННЫЕ ЦИКЛЫ КИНЕТОПЛАСТИД.
Жизненные циклы двухжгутиковых кинетопластид изучены пока еще очень плохо. В первую очередь это относится к свободноживущим представителям группы.Большинство бодонид обитает в постоянных и временных водоемах, как пресных, так и с различным уровнем солености. По-видимому, многие виды достаточно легко переносят переход из соленой воды в пресную и наоборот. Бодониды в изобилии встречаются в почве и охотно поселяются на различных органических субстратах (фекальные массы, компосты и т. п.). Большинство бодонид питаются бактериями, захватывая их мощно развитым цитостомом (Bodo designis, В, curvifilus), В пищеварительных вакуолях жгутиконосцев можно встретить и мелкие водоросли, и оформленные органические частички. Есть среди бодонид и облигатные хищники (Rhynchobodo), добычей которых служат мелкие жгутиконосцы. Вместе с тем ряд жгутиконосцев (например, В. caudatus) может сочетать бактериофагию и хищничество. Экспериментально показано, что бо- дониды могут длительное время питаться растворенными органическими веществами, сохраняя способность к размножению. Большинство бодонид — это свободноплавающие или ползающие формы. Характер их движения настолько специфичен, что при известном навыке позволяет по одному этому признаку определить род, а иногда и вид наблюдаемого объекта. Некоторые бодониды, например В. saltans, способны прикрепляться своим задним жгутиком к субстрату, однако легко утрачивают эту связь и переходят к активному плаванию. Жизненный цикл большинства бодонид» по всей видимости, не сопряжен с упорядоченным чередованием стадий или фаз развития. В благоприятных условиях жгутиконосцы интенсивно питаются и размножаются путем равных бинарных делений. При неблагоприятных условиях некоторые виды бодонид формируют цисты. При этом жгутиконосцы втягивают жгутики и секретируют внешнюю оболочку — стенку цисты. Изменения в строении самих жгутиконосцев незначительны. Несколько возрастает электронная плотность цитоплазмы, перестает функционировать сократительная вакуоль. Кристы митохондриона либо деградируют, либо изменяют свою форму. В последнем случае дисковидные кристы трансформируются в ампуловидные. В цистах жгутиконосцы переживают неблагоприятные условия, деления клеток не происходит. Единого мнения о том, насколько широко среди бодонид распространена способность к формированию цист, пока нет. В литературе наиболее часто встречается описание процесса цистообразования у Bodo caudatus.
Единственным видом бодонид, перешедшим к облигатному паразитизму, является Ichthyobodo nесаtor. Эти жгутиконосцы поселяются на жаберном эпителии молоди пресноводных рыб, а также на поверхности тела взрослых особей. Прикрепление жгутиконосцев к эпителию происходит при помощи видоизмененного переднего конца их тела, который погружается в частично разрушающиеся ткани. Интенсивное размножение паразитов происходит путем продольных бинарных делений. Цитокинез обычно существенно отстает по времени от делений клеточных органелл, так что в популяции жгутиконосцев часто выявляется много четырехжгутиковых особей. Некротические очаги, возникающие в местах скопления паразитов, приводят к глубокой деградации тканей, что зачастую влечет за собой гибель рыб, особенно молоди.
Жизненные циклы свободноживущих криптобиид (Procryptobia, Dimastigella, Cruzella, Cephalothamnium) изучены в еще меньшей степени, чём у бодонид. По пищевым потребностям и способу питания эти криптобииды, видимо, ничем не отличаются от представителей сем. Bodonidae. Большинство из них представлены свободноплавающими или ползающими по субстрату в поисках пищи формами. Только жгутиконосцы Cephalothamnium cyclopum, поселяющиеся на теле пресноводных ракообразных, формируют стебельчатые колонии, насчитывающие до 30 особей. Жгутиконосцы Dimastigella trypaniformis, обитающие в почве, могут образовывать цисты. У других видов свободноживущих криптобиид способы переживания ими неблагоприятных условий неизвестны.
Большинство представителей сем. Cryptobiidae — это паразиты позвоночных и беспозвоночных животных. Степень освоения криптобиями разных групп хозяев неодинакова. 2 вида этих жгутиконосцев описаны из репродуктивных органов брюхоногих моллюсков, по 1 виду — из пищеварительной системы планарий, пиявок и рептилий. Наконец, около 50 видов криптобий известны как паразиты морских и пресноводных рыб. Жизненные циклы криптобий, паразитирующих в беспозвоночных животных и рептилиях, практически неизвестны. Жгутиконосцы размножаются в хозяевах путем продольных бинарных делений. Паразитирующие в гастроподах Cryptobia helicis и С. carinariae способны прикрепляться к эпителию семенных мешков своих хозяев при помощи передних жгутиков. У С. dendrocoeli, паразитирующей в пищеварительной системе планарии Dendrocoelum lacteum, описаны внутриклеточные стадии развития. Принято считать, что криптобии из водных беспозвоночных имеют в своих жизненных циклах свободноживущие стадии, посредством которых и осуществляется циркуляция паразитов в популяции хозяев.
Жизненные циклы криптобий, паразитирующих в рыбах, сложны и разнообразны. Можно выделить 3 основных типа паразито-хозяинных отношений, реализующихся в жизненных циклах криптобий. В первом случае жгутиконосцы выступают в качестве эктопаразитов, поселяясь на поверхности тела и жаберном эпителии главным образом пресноводных рыб. Биология эктопаразитических видов криптобий слабо изучена. Часть жгутиконосцев, например Cryptobia carassi, поселяющиеся в слизи на поверхности тела хозяев, являются, по сути, комменсалами. Однако жгутиконосцы, которые заселяют жаберный эпителий рыб, например С. branchialis, могут быть причиной заболевания и массовой гибели рыб, особенно их молоди. Эти жгутиконосцы прикрепляются к поверхности ткани при помощи видоизмененного жгутика и интенсивно размножаются путем продольных бинарных делений. Дочерние особи прикрепляются к поверхности эпителия и также делятся. Интенсивное размножение паразитов, вероятно, приводит к блокаде поверхности жабр и соответственно нарушению дыхания. Следует, однако, отметить, что, возможно, ряд эктопаразитических криптобий, а с точки зрения By (Woo, 1987) — большинство, на самом деле не являются самостоятельными видами, а представляют собой стадии развития жгутиконосцев, паразитирующих в кровеносной системе рыб. Как мы увидим ниже, для такого предположения есть серьезные основания.
Вторая группа (около 7 видов криптобий) представлена паразитами кишечника или (в редких случаях) других внутренних органов рыб. Почти все они, за исключением С. jubilans, описаны из морских рыб. Жгутиконосцы размножаются путем продольных бинарных делений в содержимом кишечника, не прикрепляясь к поверхности энгероцитов. Немногочисленные экспериментальные данные свидетельствуют о том, что передача криптобий от хозяина к хозяину может происходить тремя основными путями: 1) непосредственно через воду, свободными жгутиконосцами; 2) через временных накопителей (беспозвоночных, служащих пищей для хозяев); 3) при хищничестве или каннибализме. Вероятно, большинство из этих видов (С. dahlii, С, stilbia, С, intestinalis и т. п.) непатогенны для своих хозяев, и часто их рассматривают как эндокомменсалов рыб. Однако С. jubilans высоко патогенна для своих хозяев — пресноводных рыбок Herichthys cyanoguttatum. Кроме пищеварительной системы эти жгутиконосцы инвазируют многие внутренние органы: печень, селезенку, яичники и могут проникать в кровь, где размножаются в макрофагах. Однако в крови вне макрофагов паразиты отсутствуют.
Третья и самая большая группа криптобий, насчитывающая, по разным данным, от 30 до 40 видов, включает облигатных кровепаразитов рыб. Эти криптобии описаны и в морских и в пресноводных хозяевах. Главной особенностью этих видов является их гетероксенность. Переносчиками жгутиконосцев служат пиявки. Таким образом, жизненный цикл жгутиконосцев включает минимум две фазы. Одна из них протекает в позвоночном, а другая — в беспозвоночном животном-хозяине. В крови рыб развитие криптобий протекает по стандартной схеме: резко нарастающая инвазия переходит в хроническую форму, сопровождающуюся постепенным снижением численности паразитов. Единичные особи обнаруживаются в крови хозяев через год и более с момента заражения. Размножение криптобий в крови рыб обычно протекает по типу бинарных делений. Данные о возможности неоднократных делений нуждаются в проверке. Бинарные деления могут протекать по-разному у разных жгутиконосцев. By (Woo, 1987) выделяет 2 основные их формы. В первом случае, как это описано у Cryptobia catas- tomi, жгутиконосцы перед делением округляются и в результате деления формируют 2 одинаковые клетки. Другой тип деления описан у С. salmositica. В этом случае жгутиконосцы перед цитокинезом как бы вытягиваются в длину, деление начинается с заднего конца, а формирующиеся особи различаются по форме тела (широкие и узкие). Кроме того, при первом типе деления дочерние особи формируют по 1 новому жгутику, а другой получают от материнской особи. Второй тип деления характеризуется тем, что одна из дочерних особей (узкая форма) формирует оба жгутика заново. Многие кровепаразитические криптобии, например С. borreli или С. salmositica, не обладают выраженной специфичностью по отношению к позвоночным хозяевам. Однако есть виды, которые используют, по-видимому, довольно узкий круг хозяев. Примером такого рода может служить С. catostomi.
О патогенности кровепаразитических криптобий имеется много сведений, особенно в старой литературе. Однако Лом (Lorn, 1979) и By (Woo, 1987) полагают, что часто приписываемая криптобиазам гибель рыб на самом деле происходит по другим причинам. Тем не менее для некоторых видов удалось проследить патогенное воздействие на хозяина, в том числе и экспериментальными методами. Пример тяжелого течения криптобиаза демонстрирует С. salmositica. Главными признаками острой формы заболевания служат экзофтальмия, спленомегалия, нарастающая анемия и растяжение брюшины асцитной жидкостью. Криптобиаз служит причиной гибели молоди лососевых и особенно опасен в рыбоводческих питомниках, где может принимать характер эпизоотии.
Развитие криптобий в переносчиках связано с интенсивным размножением паразитов, но в отличие от трипаносом практически не сопровождается чередованием морфологических форм жгутиконосцев. Так, С. beckeri, паразит морской рыбы Scorpaenichthys marmoratus, попадая с кровью хозяина в пищеварительную систему пиявки Malmiana diminuta, претерпевает серию бинарных делений, и уже через 72 ч его инфективные стадии локализуются во влагалище хоботка. Эти стадии отличаются от жгутиконосцев из кишечника пиявки лишь более мелкими размерами. Темпы развития паразитов соответствуют времени переваривания пищевого комка и в значительной степени зависят от окружающей температуры. Так, жгутиконосцы Cryptobia bullocki формировали инфективные стадии при температуре воды 5 °C через 10 дней после попадания в морскую пиявку Calliobdella vivida, а при температуре 20 °C — уже через 24 ч. Заражение новых особей рыб происходит при нападении на них зараженных криптобиями пиявок. Со слюной пиявки в кровеносную систему рыбы вводятся жгутиконосцы, которые, по- видимому, тут же приступают к размножению.
Очень важной чертой в биологии ряда кровепаразитических криптобий является способность к прямой (без участия переносчика) передаче паразитов от хозяина к хозяину. Типичный пример такой передачи можно наблюдать у Cryptobia sal- mositica. При совместном содержании зараженных и незараженных особей радужной форели примерно у 80% последних можно обнаружить присутствие криптобий в крови спустя четыре месяца после начала эксперимента. Эта величина оказывается несколько ниже (50 %), если садок разделить проволочной сеткой, препятствующей прямым контактам между зараженными и незараженными рыбами. Примерно через 6 нед после заражения хозяина криптобии начинают появляться в слизи на поверхности тела рыб. Эти «эктопаразитические» формы, если их инокулировать в кровь хозяина, заражают его, и дальнейшее развитие криптобий протекает по обычному сценарию. Однако каков естественный путь криптобий с поверхности тела рыбы реципиента в ее кровеносную систему, пока неизвестно. Хотя биология трипаносоматид изучена гораздо глубже и полнее, чем у остальных представителей кинетопластид, остается немало открытых вопросов, касающихся хода их жизненного цикла. Так, применение электронного микроскопа, особенно при изучении паразито-хозяинных отношений трипаносоматид и беспозвоночных животных, позволило выявить ряд форм или стадий жгутиконосцев, роль которых в жизненных циклах трипаносоматид неясна. В первую очередь это касается внутритканевых стадий развития паразитов и многоядерных, или «гигантских», форм. Кроме того, до сих пор ничего не известно о формах полового процесса и его месте в жизненном цикле этих жгутиконосцев.
Размножение трипаносоматид.
Жизненные циклы трипаносоматид, как правило, включают несколько стадий, принимающих участие в эндогенной агломерации паразитов. Исключение составляет лишь Trypanosoma equiperdum, вторично утратившая переносчика и обладающая, по сути, одним, растянутым во времени циклом размножения. Стадии, на которых размножаются трипаносомати- ды, представлены разными морфологическими формами. Часто клеточные деления предшествуют процессам клеточной дифференцировки, связанным со сменой стадий или морфологических форм жгутиконосцев, или сопровождают их. Связь размножения трипаносоматид с половым процессом пока не установлена. Здесь можно вспомнить, что до недавнего времени трипаносоматид вообще относили к агамным простейшим.Формы делений у трипаносоматид весьма разнообразны. В этой группе протистов встречаются и бинарные и множественные деления, причем и те и другие могут быть и эквивалентными и неравными. Наиболее обычной формой деления у трипаносоматид являются эквивалентные бинарные деления, т. е. деления, приводящие к образованию 2 приблизительно равных по размеру и сходных по морфологии дочерних клеток. Чаще всего такое деление начинается с изменений в организации двигательного аппарата, затем происходит деление кинетопласта и вслед за ним — митоз. По времени с этим процессом совпадает начало цитокинеза, который обычно связан с расхождением передних концов клеток трипаносоматид, однако иногда наблюдается и обратная картина. Деление клетки, начинающееся с ее заднего конца, в ряде случаев, по-видимому, сопряжено с формированием гигантских многоаксо- немных жгутов, объединяющих «грозди» жгутиконосцев.
К неравным бинарным делениям относится «почкование», описанное у гомоксенных трипаносоматид в связи с формированием «strap-hangers» — цистоподобных стадий, прикрепляющихся к жгутику материнской особи. В данном случае очередность дупликации органелл та же, что и в предыдущем случае, однако в процессе почкования сначала всегда обособляется задний конец «почки», а затем борозда деления смещается в сторону передних концов родительской и дочерней клеток. Неравные бинарные деления известны и у трипаносом. Например, некоторые трипаносомы из крови рыб и амфибий, попадая в пищеварительную систему пиявок, первое время размножаются именно таким способом. В этом случае делящаяся трипомастигота дает начало 2 морфологически отличным формам: удлиненной и округлой.
В литературе встречается описание бинарных делений, характеризующихся поперечным цитокинезом. Эта форма делений еще мало исследована. Известно, что цитокинезу в данном случае предшествует миграция органоидов к противоположным полюсам клетки, вслед за чем она перешнуровывается примерно посередине.
Большой интерес представляют множественные деления трипаносоматид. Эти деления могут рассматриваться как результат отставания процессов цитокинеза от темпов удвоения клеточных органоидов. В жизненных циклах трипаносоматид регулярно происходящие множественные деления описаны только у трипаносом. Эндогенная агломерация паразитов, осуществляемая путем множественных делений, характерна для представителей подрода Негре- tosoma. У большинства этих трипаносом множественные деления жгутиконосцев протекают в крови или в других тканях позвоночных животных, однако у Trypanosoma lewisi, кроме того, они происходят и внутри клеток кишечного эпителия блох. Множественные деления трипаносом в клетках кишечного эпителия насекомых-переносчиков описаны также у Т brucei и Т cruzi. Сходным образом в клетках слюнных желез клопов размножаются Т. rangeli и Phytomonas serpens. В лабораторных культурах множественное деление описано у Trypanosoma сопо- rhini. В процессе множественного деления у трипаносоматид формируются так называемые гигантские клетки. Интерес к этим стадиям объясняется их возможной причастностью к половому процессу.
Развитие трипаносоматид в позвоночных животных
В позвоночных животных развитие трипаносоматид приурочено главным образом к кровеносной системе. Считается, что паразитирование жгутиконосцев в тканях внутренних органов, не связанных непосредственно с кровеносной системой, носит у трипаносоматид характер вторичных адаптаций. Однако в последнее время это положение было поколеблено. Выяснилось, что в южноамериканских сумчатых и грызунах некоторые трипаносомы, относящиеся к подродам Schisotrypanum, Megatrypanum и Herpetosoma, могут развиваться в пищеварительной системе хозяев, а именно в их ректальных железах. Если к тому же учесть многочисленные описания трипаносоматид из кишечника различных рептилий, то, как нам кажется, не следует исключать возможность реализации алиментарной фазы жизненного цикла в позвоночном-хозяине, по крайней мере у части трипаносоматид.В кровеносной системе позвоночных животных возможны 3 различных пути развития трипаносоматид. Первый из них представлен в жизненных циклах Leishmania и Endotrypanum. Этот путь связан с поражением паразитами форменных элементов крови хозяев. 2 вида жгутиконосцев из рода Endotrypanum развиваются в эритроцитах южноамериканских ленивцев (Edentata). Эти трипаносоматиды изучены очень плохо. Известно лишь, что в эритроцитах на ранних стадиях инвазии у одного из видов обнаруживаются эпи-, а у другого — трипомастиготы. Клиника заболевания неизвестна.
Мишенью для лейшманий служат мононуклеар- ные фагоциты (макрофаги) хозяев, в которых лейшмании размножаются в форме эндомастигот. Разрушение москитом при помощи хоботка эпидермальных клеток и введение в ранку слюны стимулируют приток макрофагов к месту укуса. Судьба паразитов, которых зараженный москит инокулирует в ткани хозяина, различна. Жгутиконосцы, попавшие непосредственно в кровь, гибнут, как и многие особи, захваченные фагоцитами. Только в нестимулирован- ных макрофагах промастцготы выживают, трансформируются в эндомастиготы и приступают к размножению, только внутри этих клеток паразиты могут разноситься по организму хозяина. Сыворотка крови одинаково губительна и для промастигот и для эндомастигот лейшманий. Передача эндомастигот между макрофагами происходит при разрушении зараженных клеток и захвате эндомастигот новыми макрофагами. Лейшманиозы проявляются у позвоночных животных в виде более или менее значительных некротических очагов, образующихся в местах локализации паразитов. Существуют 2 основные формы лейшманиозов — кожная, в результате которой поражается ретикуло-эндотелиальная система кожи и подкожная клетчатка, и висцеральная, характеризующаяся широким поражением организма хозяина, включая практически все ^системы внутренних органов. Второй путь связан с развитием жгутиконосцев в крови хозяина без поражения ими форменных элементов крови и клеток тканей внутренних органов.
По такому типу происходит развитие трипаносом в низших позвоночных животных, а также трипаносом подрода Megatrypanum в млекопитающих. Эта группа циклов в настоящее время выглядит достаточно целостной, однако нельзя забывать, что трипаносомы из низших позвоночных животных изучены очень поверхностно. Данный тип развития трипаносом в позвоночных-хозяевах сопряжен со слабо выраженным плеоморфизмом кровяных стадий и их низкой пролиферативной активностью. Так, у большинства трипаносом, паразитирующих в крови рыб (Lorn, 1979), размножение в позвоночных-хозяевах не происходит. Слабо выраженный плеоморфизм трипаносом в данном случае, вероятно, связан с клеточным ростом паразитов. Если же размножение происходит, то оно приурочено к кровеносному плексусу какого-либо органа (сердце, почки, костный мозг) и осуществляется в форме бинарных делений. Трипаносомы в крови амфибий и рептилий могут размножаться и путем бинарных, и путем множественных делений, часто протекающих на фоне чередования морфологических форм жгутиконосцев. Однако и здесь размножение жгутиконосцев чаще происходит не в периферической крови, а в капиллярах внутренних органов. У трипаносом амфибий обнаружено наличие циркадных ритмов, связанных с фотопериодичностью.
Трипаносомы из птиц демонстрируют чрезвычайно низкий уровень инвазии^ так что выявить их часто удается лишь методом слепого посева культур на NNN среду. Исключение составляют Trypanosoma avium backeri и Т bouffardi; последний вид, правда, выпадает из данной группы, так как может развиваться за пределами кровеносной системы хозяев. Из всех представителей подрода Megatrypanum только у Trypanosoma theileri описаны стадии, размножающиеся в крови млекопитающих. Другие представители этого подрода, по морфологии очень близкие к трипаносомам из амфибий, обладают слабым «возрастным» плеоморфизмом при хроническом течении инвазии. В отношении Т. theileri в литературе имеется очень много противоречивых данных. Часто заражение этими жгутиконосцами сопряжено со смешанной инвазией протозойной (Theileria) или иной (Anoplas- ma) природы. Так что размножение в форме амасти- гот, приписываемое этой трипаносоме, требует проверки, так же как и наличие у данного вида экстраваскулярных стадий.
Третий путь развития трипаносоматид в позвоночных животных представлен в жизненных циклах большинства трипаносом, паразитирующих в млекопитающих. Его характерной чертой является выход трипаносом за пределы кровеносной системы и их развитие в тканях различных внутренних органов своих хозяев. Среди всего многообразия такого рода циклов можно выделить 3 группы, различающиеся по особенностям экстраваскулярного развития паразитов.
В первую группу мы объединяем жизненные циклы жгутиконосцев из подрода Herpetosoma, за исключением Trypanosoma (Я.) lewisi и ряда близких к ней видов. В данном случае инвазия позвоночных животных протекает в 3 этапа. На первом этапе (инкубационный период) трипаносомы размножаются путем множественных делений в тканях различных внутренних органов хозяина, локализуясь обычно в их межклетниках. Второй этап, на котором жгутиконосцы выходят в кровь, соответствует пику паразите- мии. Этот этап ограничен во времени и постепенно переходит в следующий, на котором происходит угасание инвазии, вплоть до полного освобождения хозяина от паразитов. Обычно при этом хозяева приобретают устойчивый иммунитет к данному виду трипаносом.
Ко второй группе могут быть отнесены жизненные циклы трипаносоматид подрода Schisotrypanum. Эти жгутиконосцы используют кровеносную систему хозяев в двух целях: для расселения по его организму и для аккумуляции расселительных стадий. Попадающие в кровяное русло млекопитающего метацикли- ческие трипаносомы проникают через стенки сосудов в ткани различных органов, поражая отдельные клетки. Здесь трипаносомы трансформируются в округлые эпимастиготы (сферомастиготы), которые делятся, формируя микропопуляцию эндомастигот. Последние размножаются, насколько позволяют габариты пораженной клетки, которая в конце концов превращается в мембранный мешок, заполненный паразитами, — «псевдоцисту». После разрушения пораженной клетки эндомастиготы трансформируются в трипомастигот, которые возвращаются в кровяное русло. Их популяция плеоморфна. Узкие трипаносомы продолжают цикл развития в хозяине, повторяя путь метациклических стадий. Широкие формы трипаносом служат для заражения переносчиков. Эти формы преобладают в крови хозяев при хроническом течении заболевания. Интересно, что ряд животных выступает в качестве биологических фильтров именно этих стадий. В мышах, например, формируются штаммы Trypanosoma cruzi, характеризующиеся присутствием в крови хозяина только широких форм трипаносом. Различные штаммы Т. cruzi демонстрируют предрасположенность к развитию в тканях определенных органов. Наиболее тяжелые последствия у млекопитающих вызывает поражение трипаносомами печени, сердечной мышцы и центральной нервной системы. Будучи высокопатогенными для человека, жгутиконосцы Т. cruzi, по-види- мому, находятся в достаточно лояльных отношениях с дикими млекопитающими, среди которых много представителей реликтовых групп: сумчатые, броненосцы и муравьеды (Ноаге, 1972).
Трипаносом африканских млекопитающих обычно причисляют к «чистым» кровепаразитам, так как их размножение происходит в периферической крови хозяев. Однако эти трипаносомы встречаются в тканях практически всех внутренних органов, а в лимфоидной ткани и в спинномозговой жидкости они могут и размножаться. Эти трипаносомы обладают выраженным плеоморфизмом кровяных стадий. Длинные узкие трипаносомы ответственны за размножение паразитов. Широкие формы, процент которых возрастает в процессе ремиссии паразитемии, являются предшественниками проциклических стадий и служат для заражения переносчиков. Т. equiper- dum — типично тканевой паразит. В кровяное русло хозяина эти трипаносомы проникают только для расселения по его организму. Развитие жгутиконосцев происходит главным образом в слизистой гениталиев и в межклетниках тканей этих органов. На поздних стадиях заболевания трипаносомы проникают в слизистые рта, носа, поражают конъюктиву глаз и локализуются в подкожной клетчатке.
Вопрос о специфичности трипаносом к позвоночным животным изучен очень слабо. Считается, что большинство трипаносом млекопитающих обладают более или менее широкой специфичностью. Это демонстрируется, например, наличием лабораторных модельных животных (мыши, крысы, хомяки), на которых удается вести практически любых трипаносоматид млекопитающих. Более того, Т. brucei, например, может длительное время развиваться в крови рептилий, сохраняя при этом способность к заражению своих естественных хозяев — млекопитающих.
Представления о специфичности трипаносом низших позвоночных животных крайне противоречивы. Собственно говоря, здесь сталкиваются две крайности. Одна — это ошибочные представления об узкой специфичности этих трипаносом, формирующиеся в силу использования традиционного подхода при их описании по принципу «новый хозяин — новый вид паразита», что особенно хорошо видно на примере трипаносом рыб (Lorn, 1979). Другая крайность — это виды-«гиганты», такие как Г. rotatorium или Т. inopinatum, к которым автоматически относят большинство трипаносом из Anura (Bardsley, Harmsen, 1973), описанных на всех континентах, где встречаются эти позвоночные. В данном случае, очевидно, сборные виды трипаносом демонстрируют ошибочную картину широкой специфичности. Достоверная узкая специфичность обнаруживается у ряда трипаносоматид, паразитирующих в реликтовых группах хозяев. Таковы, в частности, Endotrypanum из американских ленивцев или Trypanosoma gray из африканских крокодилов.
Анализ литературы, посвященной вопросу специфичности трипаносоматид к позвоночным животным, позволяет сделать вывод о том, что чем ниже эволюционный уровень позвоночных животных, тем более узкую специфичность по отношению к ним проявляют трипаносоматиды. Однако, учитывая, что как раз в этих группах животных трипаносоматиды изучены очень поверхностно, мы оставляем вопрос о специфичности трипаносоматид к позвоночным животным открытым.
Развитие трипаносоматид в беспозвоночных животных.
Среди беспозвоночных животных хозяевами трипаносоматид являются в основном клещи, пиявки и насекомые. Известны отдельные находки трипаносоматид в нематодах, моллюсках, коловратках и инфузориях, однако в большинстве случаев это единичные описания, требующие дополнительных подтверждений. Исключением в данном случае является Lepto- monas, паразитирующий в макронуклеусах инфузорий. Однако эти жгутиконосцы изучены очень плохо, и характеризовать данную систему паразит—хозяин пока не представляется возможным.Из литературы известно, что клещи могут быть хозяевами как гомоксенных трипаносоматид, так и переносчиками трипаносом. Гомоксенные жгутиконосцы представлены в этой группе хозяев единственным видом Blastocrithidia hyalommae, который описан из гемолимфы иксодовых клещей. В последнее время, правда, многие исследователи все чаще сходятся во мнении, что за самостоятельный вид в данном случае были ошибочно приняты стадии Trypanosoma theileri, развивающиеся в переносчике. Развитие жгутиконосцев в гемолимфе и предполагаемая трансовариальная передача Blastocrithidia hyalommae между клещами в целом нетипичны для гомоксенных трипаносоматид. Поэтому при отсутствии достоверных экспериментальных исследований обсуждать особенности развития В. hyalommae в клещах не имеет смысла. В качестве переносчиков клещей используют некоторые трипаносомы, паразитирующие в летучих мышах, птицах и млекопитающих. Пара- зито-хозяинные отношения в этих системах пока не изучены. Однако тот факт, что в жизненных циклах трипаносом наряду с клещами в качестве основных переносчиков почти всегда фигурируют насекомые, с большой вероятностью свидетельствует о том, что освоение трипаносомами клещей носило вторичный характер.
Таким образом, пиявки и насекомые являются основными группами беспозвоночных животных, с которыми связано развитие трипаносоматид. В пиявках паразитируют только гетероксенные трипаносомы из водных позвоночных животных: рыб, амфибий и рептилий. Независимо от вида позвоночного хозяина в переносчиках-пиявках эти трипаносомы претерпевают похожее развитие. Жгутиконосцы концентрируются в желудке пиявок, где трипаносомы интенсивно делятся, часто со сменой морфологических форм. Проциклические стадии многих видов в начале эндогенной агломерации проходят через фазу множественных делений с последующей дифференцировкой, сопровождающейся бинарными делениями. В зависимости от вида трипаносом эти деления могут протекать у про- и эпимастигот или (редко) у трипомасти- гот. В желудке и других частях средней кишки пиявок трипаносомы могут прикрепляться к щеточной каемке кишечного эпителия, заякориваясь расширенным кончиком своего жгутика среди микроворсинок энтероцитов. Ряд трипаносом (вне связи с их приуроченностью к какой-либо определенной группе позвоночных-хозяев) формируют метациклические стадии непосредственно в желудке пиявок. Другие мигрируют в передние отделы кишечника, и их метациклические стадии локализуются во влагалище хоботка. Здесь они могут прикрепляться к его кутикулярной выстилке за счет внедрения в нее кончика жгутика, в котором формируются полудесмосомы. Такой тип контактов отмечен только для жгутиков трипаносом, развивающихся в пиявках. Роль метациклических стадий у трипаносом, развитие которых связано с пиявками, могут выполнять либо эпи-, либо трипомас- тиготы. Метациклические стадии трипаносом формируют в пиявках плеоморфные популяции. Этот феномен, проявляющийся в наличии узких и широких форм жгутиконосцев, пока не имеет убедительного объяснения. Высказывается точка зрения, что в переносчике таким образом закладывается плеоморфизм будущих кровяных стадий. Однако экспериментально эта идея пока не подтверждена. Единственным примером формирования метациклических стадий в слюнных железах пиявок до сих пор остается Trypanosoma barbari, паразитирующая в тритонах Triturus torosus. В пиявке Actinobdella sp. метациклические стадии этих жгутиконосцев найдены в слюнных железах и во влагалище хоботка хозяина. Однако тонкие механизмы развития этих трипаносом в слюнных железах неизвестны.
Подавляющее большинство трипаносоматид используют в качестве беспозвоночных-хозяев насекомых. В настоящее время известно более 200 видов гомоксенных и более 300 видов гетероксенных трипаносоматид, которые в своем развитии связаны с насекомыми. Среди насекомых хозяева трипаносоматид распределены по 10 отрядам. Однако возможность паразитирования трипаносоматид в Anoplura, Homoptera, Orthoptera и Trichoptera требует подтверждения из-за единичности находок и неполноты описаний. В насекомых из отрядов Hymenoptera, Le- pidoptera, Mecoptera и Siphonaptera найдено около 40 видов трипаносоматид, что составляет менее 10% от общего числа паразитов, описанных в насекомых. Все эти жгутиконосцы изучены очень плохо, кроме паразитов блох. Более 90 % трипаносоматид, развитие которых протекает в насекомых, приурочено к 2 отрядам Insecta — Diptera и Hemiptera, между которыми эти жгутиконосцы распределяются примерно поровну. Несмотря на экологические, поведенческие, анатомические и физиологические различия, существующие между насекомыми-хозяевами, развитие в них трипаносоматид протекает очень похоже. Исключением являются случаи, связанные с механическим переносом трипаносом между позвоночными животными двукрылыми кровососущими насекомыми. При этом развития жгутиконосцев в переносчике не происходит, они лишь переживают короткое время в капле крови сохраняющейся в хоботке насекомого (Ноаге, 1972). Во всех остальных случаях трипаносоматиды, попав в пищеварительную систему насекомых, претерпевают определенное развитие, связанное с закономерной сменой стадий, которая проходит на фоне нескольких циклов эндогенной агломерации, часто пространственно разобщенных, и завершают свое развитие в насекомых, формируя неразмножающиеся расселительные (метациклические) стадии. В наиболее общем случае все развитие трипаносоматид в насекомых ограничено рамками их пищеварительной системы.
Целый ряд общих черт в строении пищеварительной системы у насекомых имеет первостепенное значение в освоении этой стации трипаносоматидами. К таким чертам следует отнести наличие кутикулярных выстилок в передних и задних отделах кишечника насекомых, имеющих эктодермальную природу, наличие развитой щеточной каемки у энтероцитов эн- тодермальной средней кишки и присутствие в этом отделе перитрофической оболочки или ее аналогов.
Заражение насекомых происходит в процессе их питания. Расселительные стадии трипаносоматид, захваченные вместе с пищей, транзитом проходят кути- кулизированные отделы передней кишки и попадают в среднюю кишку. В двукрылых насекомых пищевой комок, содержащий проциклические стадии трипаносоматид, сразу изолируется здесь от стенки кишечника перитрофической оболочкой, имеющей форму мешка или трубки. Эта оболочка секретируется на границе передней и средней кишки специальными клетками. Она представляет собой динамичное образование, в котором постоянно изменяются вязкость самого секрета, длина «мешка», толщина его стенок и т. д. Ультраструктура перитрофической оболочки двукрылых насекомых обычно характеризуется наличием 2 слоев: гомогенного основного вещества и слоя по-разному ориентированных микрофибрилл. В данном отряде Insecta динамика формирования перитрофической оболочки и ее барьерная функция лучше всего изучены у мух це-це и москитов. Развитие африканских трипаносом группы Trypanosoma brucei связано с инвазией эктоперитрофического пространства мух це-це и, следовательно, с преодолением перитрофической оболочки. Это может достигаться 2 способами: или непосредственной пенетрацией оболочки, или через открытый дистальный конец этой структуры, имеющей у глоссин форму трубки. Второй путь реализуется у Т. gray и Т. congolense. Однако для Г. brucei низкие значения pH среды в задних отделах кишечника мух губительны. Проникновение этих трипаносом в эктоперитрофическое пространство происходит непосредственно через стенку перитрофической трубки. Причем единственным местом, где это может происходить, является передний слабо полимеризованный ее участок, с которым трипаносомы контактируют очень короткий промежуток времени. Именно этим объясняется очень низкая заражаемость мух це-це данным видом трипаносом. Дело в том, что только у молодых, еще не питавшихся мух этот участок достаточно обширный. У взрослых мух перитрофическая оболочка практически непреодолима для трипаносом.
При заражении москитов лейшманиями наблюдается похожее явление. На границе передней и средней кишки этих насекомых пищевой комок быстро обволакивается вязким секретом. Эта перитрофическая оболочка непреодолима для лейшманий, и они оказываются изолированными от просвета кишечника. Однако у различных видов москитов перитрофическая оболочка в процессе пищеварения ведет себя неодинаково. У некоторых видов перитрофичес- кий мешочек сохраняет свою целостность вплоть до момента дефекации насекомых. Хотя лейшманий в этом случае и могут претерпевать определенное развитие в перевариваемом пищевом комке, тем не менее они лишены возможности завершить его должным образом и полностью выводятся из организма хозяина. У других видов москитов еще до попадания пищевого комка в задние отделы кишечника перитрофическая оболочка фрагментируется и лейшма- нии оказываются в просвете кишки.
У клопов классическая перитрофическая оболочка отсутствует. Однако и в их кишечнике пищевые массы изолируются от плазмалеммы микроворсинок энтероцитов средней кишки. Прежде всего, для морфологии этого отдела пищеварительной системы полужесткокрылых характерно наличие дополнительной, внеклеточной мембраны, покрывающей плазмалемму апикальных концов энтероцитов, включая и микроворсинки. Снаружи от дополнительной мембраны в кишке клопов располагаются внеклеточные мембранные образования, часто формирующие мощные упорядоченные слои. Такие экстраклеточные, мембранные структуры топографически и, очевидно, функционально соответствуют настоящей перитрофической оболочке насекомых. Трипаносоматиды различным образом реагируют на присутствие экст- раклеточных мембранных образований в кишке клопов. Жгутиконосцы Blastocrithidia triatomae, например, способны вызывать редукцию этих образований, после чего атакуют незащищенные энтероциты хозяев — триатомовых клопов (Schaub, 1992). Однако в тех же клопах жгутиконосцы Trypanosoma cruzi не могут преодолеть барьер из экстраклеточных мембран и проходят среднюю кишку хозяев транзитом.
В других группах насекомых влияние перитрофи- ческих оболочек на ход развития трипаносоматид пока не изучено.
Дня средней кишки насекомых характерна активная перистальтика, способствующая продвижению пищевых масс, которые в этом отделе подвергаются основной ферментативной обработке. Тот факт, что в средней кишке насекомых большинство видов трипаносоматид интенсивно размножаются, свидетельствует о том, что здесь создаются оптимальные условия для их развития. Неудивительно поэтому, что большинство трипаносоматид стремятся закрепиться в данном отделе кишечника насекомых. Известно (Догель, 1947), что такого рода проблемы у многих кишечных паразитов решаются путем формирования особых прикрепительных органов (органелл). В этом смысле трипаносоматиды не являются исключением. Однако природа и строение их прикрепительных органелл весьма оригинальны. На определенном этапе жизненного цикла трипаносоматид эту функцию берет на себя их единственный жгутик, являющийся специализированной органеллой движения. Основной способ закрепления жгутиконосцев на поверхности кишечного эпителия средней кишки насекомых основан на заякоривании их в той или иной степени видоизмененных жгутиков в зоне щеточной каемки. Другим способом, позволяющим жгутиконосцам задерживаться в средней кишке хозяев, является их проникновение в толщу кишечного эпителия. В ряде случаев проникновение в стенку кишки связано с миграцией паразитов в гемолимфу и далее к слюнным железам хозяев. Примеры такого рода демонстрируют Т. rangeli, Т brucei и различные Phy- tomonas. Однако у многих гомоксенных трипаносоматид проникновение в толщу кишечного эпителия может служить для удержания паразитов в данном отделе кишечника.
В задней части средней кишки определяются основные пути дальнейшего развития жгутиконосцев. Одни виды приступают здесь к завершающей фазе своего развития в насекомых, формированию расселительных стадий. Это происходит у трипаносом из секции Stercoraria, ряда лейшманий и большинства гомоксенных трипаносоматид (Wallace, 1966). Для Trypanosoma cruzi и лейшманий показано, что запуск процессов клеточной дифференцировки их метациклических стадии индуцируется циклическим аде- нозинмонофосфатом; В насекомых-переносчиках это вещество присутствует в секрете мальпигиевых сосудов, протоки которых открываются на границе средней и задней кишки.
Некоторые трипаносоматиды все свое развитие осуществляют в задней кишке насекомых. Таковы, в частности, представители рода Crithidia. Для закрепления в этом отделе кишечника жгутиконосцы используют видоизмененные «присосковидные» жгутики, прикрепляясь ими к кутикулярной выстилке эпителия.
Трипаносоматиды, формирующие расселительные стадии в передних отделах кишечника, мигрируют из средней кишки к ротовому аппарату своих хозяев. Здесь они локализуются на кутикулярной выстилке эпителия, причем способ прикрепления идентичен способу, который трипаносоматиды используют в ректуме хозяев.
Жгутиконосцы, формирующие расселительные стадии в слюнных железах хозяев, проникают в эти органы из гемолимфы. В процессе продвижения к слюнным железам жгутиконосцам приходится активно проникать в клетки и ткани различных органов насекомых. Механизм проникновения до конца неясен и, вероятно, индивидуален у отдельных жгутиконосцев. Т. brucei проникает в энтероциты мух це-це следующим образом. Сначала жгутиконосцы индуцируют формирование инвагинационного кармана на апикальной поверхности энтероцита и вводят в него свое тело. Затем они покидают этот карман и оказываются непосредственно в цитоплазме, откуда проникают под базальную мембрану кишечника и выходят в гемолимфу. Жгутиконосцы Т.rangeli и Phytomonas serpens проникают сквозь стенку слюнных желез клопов-хозяев одинаковым способом. Базальная мембрана просто протыкается жгутиком, а у плазма- леммы клеток слюнных желез жгутик индуцирует формирование инвагинационного кармана, который замыкается в паразитофорную вакуоль. Дифференцировка расселительных стадий перечисленных видов происходит в просвете слюнных желез хозяев. У Тгуpanosoma brucei и Phytomonas nordicus этому предшествует закрепление жгутиконосцев на щеточной каемке эпителиальных клеток желез, которое происходит посредством заякоривания жгутика среди микроворсинок. Процесс проникновения Trypanosoma brucei в слюнные железы мух це-це пока неясен. Известно, что трипаносомы внедряются в стенку средней кишки, где размножаются путем множественных делений, формируя так называемые цистоподобные тела. После этого жгутиконосцы выходят в гемолимфу мух. Однако внутри клеток слюнных желез трипаносомы не обнаружены. Это заставляет предположить, что выход жгутиконосцев в гемоцель — явление в значительной степени спонтанное, а их проникновение в слюнные железы осуществляется в ходе миграции трипаносом через гипофаринкс и протоки желез. Возможно, что у разных штаммов Т. brucei могут реализовываться оба пути. Жгутиконосцы Т. rangeli, Phytomonas serpensи Ph. nordicus проникают в слюнные железы из гемолимфы.
Воздействие трипаносоматид на насекомых-хозяев изучено пока явно недостаточно. Основные факты, имеющиеся на этот счет, суммированы в ряде обзоров (Molyneux, 1977; Schaub, 1992). С нашей точки зрения, можно выделить 3 основных типа воздействий трипаносоматид на насекомых.
Первый тип — это влияние жгутиконосцев на поведение их хозяев. Так, развитие Trypanosoma rangeli в триатомовых клопах и Т. congolense в мухах це-це приводит к проявлению у их хозяев синдрома прерывистого питания. Прерывистое питание характерно и для москитов, зараженных лейшманиями. Данный эффект обычно связывают с двумя возможными причинами. Обнаружено, что трипаносомы Т. congolense в гипофаринксе мух це-це наряду с кутикулярной выстилкой этого отдела пищеварительной системы прикрепляются и к поверхности механорецепторов. Воздействие на механорецепторы, естественно, может сказываться на поведении хозяев. Однако, возможно, по крайней мере в случае с лейшманиями и москитами, что прерывистое питание связано с закупоркой паразитами канала пищеварительной системы. В данном случае атакующие позвоночных животных москиты проходят все этапы акта кровососания, однако в их пищеварительную систему кровь не поступает, или сюда попадает лишь ничтожное ее количество. У таких насекомых возникает необходимость в повторном питании и т. д.
Второй тип — это патогенное воздействие трипаносоматид на насекомых. Различные механизмы такого воздействия паразитов на их хозяев хорошо известны из курса общей паразитологии (Догель, 1947). Однако среди трипаносоматид факты существования прямого патогенного воздействия на хозяина отмечаются крайне редко (Schaub, 1992). В частности, известно, что Blastocrithidia triatomae вызывает высокую смертность среди личинок Triatoma infestans, связанную с нарушением их нормального пищеварения. Показано, что отчасти это связано с разрушением дистального отдела мальпигиевых сосудов и нарушением их секреторной деятельности.
Наконец, к третьему типу можно отнести опосредованное патогенное воздействие трипаносоматид на их хозяев. Например, активное проникновение жгутиконосцев через стенку кишки в гемоцель открывает в ряде случаев доступ к гемолимфе хозяев представителям бактериальной кишечной флоры. Инвазия гемолимфы бактериями обычно приводит к гибели насекомых.
Способы передачи инвазии
Способы заражения животных и растений трипа- носоматидами сводятся в основном к двум формам. Заражение хозяев контаминативным путем свойственно всем гомоксенным трипаносоматидам. Этим же путем происходит заражение позвоночных животных трипаносомами, относящимися к секции Stereoraria. У гомоксенных трипаносоматид заражение новых особей хозяев обычно происходит при их питании на контаминированном субстрате. У ряда видов в жизненном цикле имеются цистоподобные стадии, способные переживать во внешней среде не менее года. Контаминативное заражение позвоночных животных трипаносомами основано на активном проникновении их метациклических стадий через поврежденный эпидермис или слизистые хозяина в его кровяное русло. Это может происходить при фекальной контаминации переносчиком покровов или слизистых животного-реципиента, при поедании позвоночными животными переносчиков и при попадании в пищеварительную систему или на слизистые других органов позвоночного животного крови зараженных особей.Первый способ реализуется у Trypanosoma cruzi. Эффективность трансмиссии паразитов обеспечивается спецификой поведения триатомовых клопов в процессе питания (Ноаге, 1972). Дело в том, что у триатомин каждый акт кровососания сопровождается или завершается дефекацией насекомых. Выходящие с экскрементами клопа метациклические трипаносомы оказываются, таким образом, вблизи ранки, в которую могут попадать в дальнейшем, например при расчесывании места укуса. Таким же образом трипаносомы могут попадать на слизистые рта, носа и т. д. Этому способствует еще и тот факт, что триатомовые клопы обычно питаются на лицевой поверхности головы позвоночных животных. Существует такж:е версия, что метациклические трипаносомы Т. cruzi могут проникать в организм хозяина и через неповрежденный эпителий, но пока она не доказана.
Поедание переносчиков лежит в основе трансмиссии жгутиконосцев из подрода Herpetosoma и, вероятно, трипаносом и лейшманий, паразитирующих в рептилиях. Ранее считалось, что заражение трипано- соматидами в данном случае идет через слизистые ротовой полости хозяев. Однако пероральное заражение крыс культурой трипаносом, помеченных изотопом трития, показало, что основной мишенью для метациклических стадий Trypanosoma lewisi служат ткани желудка и кишечника, а не слизистые ротовой полости.
Третий способ может реализовываться двумя различными путями: при половых контактах животных и при циркуляции паразитов в системе хищник- жертва. Венерическая трансмиссия паразитов достоверно установлена только у Т. equiperdum. Заражение через кровь жертв в процессе питания, вероятно, распространено довольно широко, но изучено в отношении трипаносоматид пока очень плохо. Классический пример, имеющийся во всех учебниках, — это заражение летучих мышей-кровососов Desmodes го- tundus жгутиконосцами Trypanosoma evansi в процессе питания вампиров кровью лошадей. Хищничество и каннибализм также могут способствовать циркуляции паразитов в популяциях хозяев. Примеры такого рода известны для ряда трипаносом, однако стабильность такого типа передачи пока не доказана.
Инокулятивное заражение хозяев основано на аккумуляции паразитов в районе ротового аппарата переносчиков или в органах, непосредственно с ним связанных (слюнные железы, зоб Diptera). Этим способом осуществляется заражение низших позвоночных животных трипаносомами через переносчиков- пиявок. Таким же способом попадают в позвоночных животных трипаносомы, относящиеся к секции Salivaria, Leishmdriia, Trypanosoma rangeli и жгутиконосцы из рода Phytomonas, паразитирующие в тканях растений. Перенос паразитов может осуществляться механически, или же формированию инфек- тивных стадий предшествует определенное развитие жгутиконосцев в переносчиках. Возникновение механической .передачи паразитов, вероятно, сопряжено с выходом трипаносом за границы ареала исходного переносчика и вторичным включением в их жизненный цикл неспецифических переносчиков. Пример такого рода демонстрирует Trypanosoma evansi. Выход этого вида на север Африки за границу обитания мух це-це и последующее распространение трипаносом на широких пространствах Евроазиатского и Американского континентов происходили, вероятно, благодаря включению в их жизненный цикл в качестве переносчиков слепней (Tabanidae). Среда кишечника этих двукрылых губительна для трипаносом, однако в ротовом аппарате насекомых жгутиконосцы короткий период времени сохраняют жизнеспособность. Прерывистый характер питания слепней, сопровождающийся частой сменой жертв, оказался достаточным условием для устойчивой циркуляции паразитов в популяции хозяев (Ноаге, 1972).
За рамками рассмотренных примеров остался еще 1 способ передачи паразитов между их хозяевами. Речь идет о трансовариальной трансмиссии трипаносоматид у беспозвоночных животных и трансплацентарной инвазии плода у позвоночных. До недавнего времени постулировалось наличие трансовариальной передачи в жизненных циклах 4 видов гомоксенных трипаносоматид: Leptomonas pyrrhocorisв клопах Pyrrhocoris apterus, L. rhinoestri в Rhinoestrus nivar- letti (Oestridae), L. jaculum в клопах Nepa cinerea и Blastocrithidia hyalommae в клещах из рода Hyalomma. Однако сейчас уже очевидно, что визуальное обнаружение жгутиконосцев в органах репродуктивной системы насекомых-хозяев не является достаточным основанием для установления факта трансовариальной передачи паразитов. Экспериментально трансовариальная передача пока ни для одного из перечисленных видов не подтверждена.
Трансплацентарная инвазия плода позвоночных животных описана у Trypanosoma brucei, Т. cruzi и Leishmania sp. (висцеральная форма). Распространенность этого явления среди диких животных пока практически не изучена. Известно, что Trypanosoma theileri осуществляет нормальное развитие в культуре клеток плода коровы. Т. musculi в период репродуктивной фазы цикла концентрируется на плаценте в материнском организме, однако потомству мышей не передается. Вероятно, следует заключить, что ни трансовариальная передача трипаносоматид у беспозвоночных животных, ни трансплацентарная передача у позвоночных животных не получили широкого распространения в данной группе паразитов. В тех случаях, когда такого рода передача все же имеет место, она принадлежит к разряду сопутствующих явлений и всегда подкрепляется одним из перечисленных выше способов трансмиссии паразитов.
ФИЛОГЕНИЯ
В обширной и очень неоднородной по составу группе низших эукариот, которых объединяют под общим названием жгутиконосцы, кинетопластиды занимают особое положение. Характерный план строения их клетки, центральным элементом которого является кинетопласт, определяет четкие границы этого таксона и не оставляет сомнений в мрно- филетическом происхождении его представителей. Среди других жгутиконосцев наиболее близки к кинетопластидам эвгленовые. В пользу этого свидетельствует заметное сходство в организации цитоскелета и двигательного аппарата у представителей обеих групп и наличие в их жгутиках похожих параксиальных структур, формирующихся к тому же за счет гомологичных белков (Kivic, Walne, 1984). Факт филогенетического родства кинетопластид и эвгленовых жгутиконосцев подтверждается и молекулярно-биологическими исследованиями по сравнительному сиквенсу генов их рРНК. Считается, что обе группы имеют общее и очень древнее происхождение, а их обособление и последующая дивергенция произошли еще до возникновения большинства ныне существующих таксонов эукариот (Cavalier-Smith, 1993).Гораздо меньше ясности в вопросе о филогенетических отношениях между отдельными группами самих кинетопластид. Надо заметить, что со времени сведения в один таксон бодонид, криптобий и трипаносоматид (Honigberg, 1963) и до начала 90-х гг. этот вопрос не поднимался. А до работы Хонигберга он просто не возникал, поскольку все 3 группы обычно помещались в системе либо независимо друг от друга, либо в ранге родов или семейств среди многих других «зоомастигофор». Так что единственным вопросом, который привлекал к себе внимание исследователей все это время, был вопрос о происхождении и эволюции трипаносоматид.
Интересно, что уже в начале XX столетия были предложены, а затем отвергнуты практически все возможные варианты гипотез происхождения Тгу- panosomatidae и эволюции их отдельных групп. В 1904 г. в работе, посвященной изучению морфологии трипаноплазмы (=Cryptobia), французский зоолог Леже (Leger, 1904а) высказал предположение, что эти двухжгутиковые простейшие являются предками трипаносом. Такое предположение целиком базировалось на обнаружении у трипаноплазмы «ун- дулирующей мембраны». Однако в том же 1904 г. в другой своей работе Леже (Leger, 1904b) частично отказывается от этой гипотезы. Он считает, что, вероятно, только небольшая часть видов трипаносом связана в своем происхождении с трипаноплазмами, тогда как большинство представителей семейства {Trypanosoma, Leishmania) произошли от жгутиконосцев из кишечника насекомых — таких как Leptomonas и Crithidia (Blastocrithidia). Идея дифилетического происхождения трипаносоматид неожиданно нашла признание у ряда исследователей того времени. Альтернативная гипотеза была предложена в 1908 г. немецким зоологом Минхиным (Minchin, 1908). Годом раньше этот исследователь описал наличие цист в жизненном цикле Trypanosoma gray из крокодилов (как стало известно позднее — ошибочно). Основываясь на этом факте, а также на том, что, по его мнению, трипаносоматиды в целом более специфичны по отношению к позвоночным животным, чем к беспозвоночным, Минхин заключает, что именно позвоночные животные были первичными хозяевами трипаносоматид. По его мнению, предки трипаносоматид могли обитать в кишечнике древних Vertebrata, откуда периодически попадали в кровеносную систему хозяев. Когда они уже вполне адаптировались к кровепаразитизму, в циклы их развития смогли включиться в качестве переносчиков кровососущие беспозвоночные. Интересно, что хотя эта гипотеза не раз воскрешалась позднее многими исследователями, самим автором она была категорически отвергнута 6 лет спустя. Причем произошло это под влиянием новой гипотезы Леже (Leger, Du- bosque, 1910). К этому времени Леже окончательно разочаровался в идее «трипаноплазменной» природы трипаносоматид и утвердился в мнении, что предками кровяных жгутиконосцев могли быть только мо- ногенетические паразиты кишечного тракта насекомых. Именно эта гипотеза, причем с минимальными изменениями, и составляла до недавнего времени ост нову представлений о происхождении и эволюции трипаносоматид. Гипотеза Леже, однако, не могла ответить на вопрос о происхождении трипаносоматид, паразитирующих у насекомых, или, как их стали называть, «низших» трипаносоматид. Эта роль явно не подходила бодонидам и криптобиям, поскольку ни те ни другие не освоили в качестве хозяев насекомых. Долгое время этот вопрос, правда, не стоял остро, так как в литературе имелось описание «свободноживущей трипаносоматиды» Prolepto- monas faecicola, найденной в почве, контаминированной фекалиями овец (Woodcock, 1914). Однако позднее выяснилось, что описанный Вудкокком жгутиконосец не относится к кинетопластидам (Le Ray, Vickerman, 1976). Именно этим обусловлено введение в более поздние схемы гипотетического предка трипаносоматид. Предполагалось, что это были свободноживущие лептомонасподобные организмы. Сначала они освоили в качестве хозяев беспозвоночных животных. Гоар (Ноаге, 1972) считает, что это были специфичные паразиты насекомых. Бакер (Baker, 1974) предполагает, что кроме насекомых, а вероятнее, и до них, такие жгутиконосцы освоили кольчатых червей, причем ту ветвь их эволюции, которая позднее дала начало насекомым. Лептомонасподобные жгутиконосцы в процессе эволюции дивергировали, дав начало 2 основным линиям трипаносоматид — промастиготной и эпимасти- готной. Первая объединила гомоксенных Leptomonas, Crithidia, Herpetomonas и дала начало гетероксенным Leishmania и Phytomonas. Эпимастиготная линия через гомоксенных Blastocrithidia и, возможно, Rhyn- choidomonas (эти жгутиконосцы пока не изучены) привела к обособлению различных Trypanosoma. Однако эта гипотеза плохо объясняет возникновение паразитарных систем, включающих водных позвоночных, главным образом рыб, пиявок и трипаносоматид. В построениях Гоара этот вопрос не рассматривается. Бакер и здесь использует гипотетических предков. По его мнению, существовала рано отошедшая от общего ствола эволюционная ветвь гомоксенных трипаносоматид — паразитов аннелид. Эти жгутиконосцы при обособлении пиявок перешли в них, а позднее получили доступ к водным позвоночным, которых и освоили в качестве новых хозяев.
Известно, что гомоксенные трипаносоматиды развиваются в кишечнике насекомых и формируют свои расселительные стадии в его. задних отделах. Формирование расселительных стадий в «задней позиции» рассматривается как исходное и для трипаносом. Все трипаносомы млекопитающих, обладающие таким развитием, объединяются в секцию Stercoraria. От этой группы, по мнению Гоара, в процессе совершенствования паразито-хозяинных отношений произошли африканские трипаносомы, объединяемые им в секцию Salivaria, которые являются наиболее продвинутыми в эволюционном плане представителями семейства.
Факт освоения мух це-це двумя столь непохожими трипаносомами, какими являются Trypanosoma gray и T. brucei, стал исходной точкой в альтернативной гипотезе происхождения африканских трипаносом, предложенной By (Woo, 1970)? Этот исследователь в серии экспериментов доказал, что Т, brucei может длительное время сохранять жизнеспособность в крови рептилий и в дальнейшем вновь заражать млекопитающих. Он предположил, что предками африканских трипаносом млекопитающих могли быть не гипотетические Stercoraria, а жгутиконосцы из крови тропических рептилий, подобные Trypanosoma gray. По его мнению, в паразитарную систему Reptilia— Trypanosoma—Hirudinea сначала в качестве неосновного переносчика могли включиться Glossina. Расширение трофических связей этих кровососов позднее привело к переносу паразитов рептилий на млекопитающих, к обитанию в которых они в конце концов приспособились. Недавнее происхождение этих паразитарных систем объясняет высокую патогенность трипаносом для целого ряда млекопитающих.
Существовали, однако, две точки зрения, отражающие иное понимание возможной эволюции трипаносоматид. Обе они не аргументированы и, строго говоря, не являются даже гипотезами, но тем не менее представляют большой интерес. Грассе, анализируя взгляды Леже, высказал предположение, что эволюция трипаносоматид могла идти по пути последовательного освоения жгутиконосцами позвоночных животных в строгом соответствии с возрастанием их эволюционного ранга: от рыб к млекопитающим. Формирование наземных паразитарных систем при этом сопровождалось бы сменой переносчиков: пиявок заменяли кровососущие насекомые (Grasse, 1952). В то же время Уоллес не исключал, что предки трипаносоматид могли быть кровепаразитами. С одной стороны, переход паразитов из крови относительно крупных позвоночных животных в более мелких переносчиков легче поддается объяснению, когда речь идет о неустоявшихся паразитарных системах. С другой стороны, и лейшманий, и многие трипаносомы хорошо растут в лабораторных культурах и способны выживать и даже размножаться в кишечнике и гемолимфе неспецифичных насекомых. Напротив, гомоксенные трипаносоматиды в крови позвоночных животных очень быстро гибнут (Wallace, 1966).
К началу 90-х гг. был накоплен уже значительный по объему материал, касающийся ультратонкой организации различных кинетопластид. Это позволило по новому подойти к решению вопроса о филогенетических отношениях между бодонидами, криптобиями и трипаносоматидами.
В группах протистов, лишенных палеонтологической летописи, филогенетические построения и определение эволюционного ранга их отдельных представителей могут основываться на результатах сравнительно-морфологических исследований ныне живущих организмов. В основе этого метода лежит выявление исходного (анцестрального) плана строения и анализ эволюционных рядов гомологичных признаков.
Поскольку возникновение паразитизма в эволюции эукариот носит вторичный характер, то естественно рассматривать организацию свободноживущих гетеротрофных бодонид как исходную в эволюции кинетопластид. Тогда особенности организации криптобий и трипаносоматид следует оценивать с точки зрения эволюционных преобразований исходного(бодонидного) плана строения их клеток.
Оказалось (Фролов, 1993), что по всем основным признакам (организация покровов, двигательного аппарата, ротового аппарата и т. п.) кинетопластиды образуют следующий эволюционный ряд: свободноживущие бодониды—криптобии-—трипаносомы (Trypanosoma) — остальные трипаносоматиды (лейшманйи,) эндотрипанум и все гомоксенные паразиты насекомых).
Причем криптобии и трипаносомы (особенно трипаносомы рыб и Т. cruzi) демонстрируют удивительно высокий уровень гомологий.
Эти выводы легли в основу новой гипотезы происхождения и эволюции трипаносоматид. Согласно этой гипотезе, одна из групп свободноживущих гетеротрофных бодонид дала начало древним криптобиям. Магистральным направлением в эволюции криптобий стало освоение ими в качестве хозяев древних позвоночных животных — рыб. Криптобии демонстрируют все возможные формы таких отношений, вплоть до перехода к облигатному паразитизму, в том числе к наиболее сложной его форме — кровепаразитизму. Первоначально, вероятно, формировались двухзвенные паразитарные системы. В этих системах осуществлялась прямая передача паразитов между хозяевами без участия переносчиков. Примеры таких циклов развития мы находим и у некоторых современных видов криптобий. Жгутиконосцы размножались в крови хозяев, затем выходили во внешнюю среду, находили новых хозяев и через покровы их тела вновь проникали в кровяное русло. Позднее возникали трехзвенные системы, в которых функцию переносчиков стали выполнять пиявки. Именно в такой паразитарной системе, включающей криптобий, рыб и пиявок, стало возможным появление специализированных одножгутиковых кровепаразитов — трипаносом. Позднее вместе с переносчиками трипаносомы начали осваивать новые группы позвоночных животных: сначала амфибий, а затем и рептилий. Выход позвоночных на сушу знаменовал собой начало формирования наземных паразитарных систем. Этот процесс был неминуемо связан со сменой переносчиков. Ими стали кровососущие насекомые. Жизненные циклы некоторых трипаносом из современных амфибий и рептилий, использующих в качестве переносчиков и пиявок, и насекомых, хорошо моделируют возможность такого перехода. Адаптация к пищеварительной системе насекомых открыла трипаносомам путь к занятию новой экологической ниши. Дальнейшая их эволюция шла, таким образом, в двух направлениях. С одной стороны, они осваивали (вместе с переносчиками) новые группы позвоночных животных (так, вероятно, трипаносомы тропических рептилий дали начало ветви африканских трипаносом млекопитающих, а лёйшмании рептилий приспособились к паразитированию в млекопитающих), а с другой стороны — насекомых. Возникновение гомоксенных трипаносоматид могло быть связано с группами хищных насекомых, в частности клопов, жертвами которых становились переносчики трипаносом. Возможно, что сами переносчики сочетали оба типа питания и это приводило к периодической изоляции паразитов от их хозяев — позвоночных животных. Утрата позвоночного хозяина не всегда приводит к гибели паразитов. Известно, например, что Т. cruzi может передаваться от одной особи клопов редувиид к другой при каннибализме. То что эволюция гомоксенных трипаносоматид из насекомых теснейшим образом связана с насекомыми — переносчиками трипаносом, подтверждается и тем фактом, что 90 % видов «низших» трипаносоматид описано из двукрылых, клопов и блох, т. е. из тех отрядов насекомых, в которых гематофагия получила наибольшее развитие и к которым приурочены основные переносчики гетероксенных трипаносоматид.
Нетрудно заметить, что предложенная гипотеза полностью противоречит прежним взглядам на эволюцию кинетопластид. Филогенетическое древо, построенное на основе гипотезы Леже, оказывается попросту перевернутым. Новая гипотеза нашла подтверждение в недавней серии работ разных исследователей (Fernandes et al., 1993; Maslov et al., 1995, 1996), использовавших методы молекулярной филогении. Полученные в этих работах данные однозначно указывают на то, что гетероксенные трипаносомы появились значительно раньше, чем гомоксенные паразиты насекомых, которые вместе с Leishmania и Endotrypanum формируют крону филогенетического древа Kinetoplastida.
Книги:
 Протисты. Руководство по зоологии. Часть 1. Алимов А.Ф. 2000
Протисты. Руководство по зоологии. Часть 1. Алимов А.Ф. 2000
 Протисты. Руководство по зоологии. Часть 2. Алимов А.Ф. 2007
Протисты. Руководство по зоологии. Часть 2. Алимов А.Ф. 2007
 Протисты. Руководство по зоологии. Часть 3. Алимов А.Ф. 2011
Протисты. Руководство по зоологии. Часть 3. Алимов А.Ф. 2011
 Жизнь животных. Том 1. Простейшие. Кишечнополостные. Черви / В. Е. Соколов - 1987
Жизнь животных. Том 1. Простейшие. Кишечнополостные. Черви / В. Е. Соколов - 1987



 Зоология беспозвоночных. Функциональные и эволюционные аспекты. В 4 томах. / Рупперт Э.Э., Фокс Р.С., Барнс Р.Д. - 2008
Зоология беспозвоночных. Функциональные и эволюционные аспекты. В 4 томах. / Рупперт Э.Э., Фокс Р.С., Барнс Р.Д. - 2008
 Вестхайде В., Ригер Р. Зоология беспозвоночных. = Spezielle Zoology. Teil 1: Einzeller und Wirbellose Tiere / пер. с нем. О. Н. Бёллинг, С. М. Ляпкова, А. В. Михеев, О. Г. Манылов, А. А. Оскольский, А. В. Филиппова, А. В. Чесунов; под ред. А. В. Чесунова. — М.: Товарищество научных изданий КМК, 2008. — С. 366—423
Вестхайде В., Ригер Р. Зоология беспозвоночных. = Spezielle Zoology. Teil 1: Einzeller und Wirbellose Tiere / пер. с нем. О. Н. Бёллинг, С. М. Ляпкова, А. В. Михеев, О. Г. Манылов, А. А. Оскольский, А. В. Филиппова, А. В. Чесунов; под ред. А. В. Чесунова. — М.: Товарищество научных изданий КМК, 2008. — С. 366—423
 Биологический энциклопедический словарь под редакцией М. С. Гилярова и др., М., изд. Советская Энциклопедия, 1989
Биологический энциклопедический словарь под редакцией М. С. Гилярова и др., М., изд. Советская Энциклопедия, 1989