ОПИСАНИЕ:
Тип Фораминиферы / Тип Foraminifera d’Orbigny, 1826
Одноклеточные организмы, тело которых защищено органической, агглютинированной или полностью секреционной раковиной, которая может быть однокамерной, псевдоколониальной, псевдокамерной и многокамерной (число камер обычно 6—15 (30), реже до нескольких сотен, в последнем случае камеры могут быть дифференцированы). Камеры связаны между собой фораменами (отверстиями), у более сложно устроенных — интегрирующими системами: столонами, внутренними устьевыми структурами, туннелями, каналами; раковины обычно имеют 1, 2 или несколько наружных отверстий — устьев, служащих местом выхода грануло- ретикулоподий (=ретикулоподий), образующих вокруг раковины ретикулум. Жизненные циклы с чередованием полового и бесполого поколений, с промежуточной редукцией. Гаметы двух- и трехжгутиковые или амебоидные. Одно из поколений (чаще половое) может отсутствовать. Ядерный аппарат со сложными изменениями в течение жизненного цикла, лишь у низших форм часть цикла одноядерна, а у остальных многоядерность сохраняется в течение всего жизненного цикла (кроме зиготы), при этом у наиболее продвинутых форм возникает ядерный дуализм. Мейоз двухступенчатый, митоз происходит по типу закрытого плевромитоза. Кристы митохондрий трубчатые, у планктонных форм имеются криптосомы и микровилли. Преимущественно морские донные свободножи- вущие организмы, но есть и планктонные формы. Изредка наблюдается переход к паразитизму. Ископаемые формы найдены в отложениях от кембрия до голоцена.Общая характеристика
Фораминиферы представляют собой естественную, хорошо очерченную группу организмов, одну из самых больших, высокоорганизованных и своеобразных среди простейших. Они включают более 4.5 тыс. родов, около 40 тыс. видов, большая часть которых (свыше 30 тыс.) — вымершие. Число современных видов, по оценке разных авторов, составляет от 5 до 10 тыс. Полное перечисление всех пер- воописаний (без исключения синонимов) в Каталоге фораминифер (США) достигает 200 000 (Hottinger, 1982). Фораминиферы представляют одну треть всех известных протистов и примерно 2.5 % всех известных на Земле организмов.Одной из самых характерных черт этой группы является наличие раковины — в простейших случаях органической, у более эволюционно продвинутых видов — агглютинированной (посторонние частицы, чаще всего песчинки, скреплены органическим или известковым цементом), у высших форм — полностью секреционной, известковой. Ультраструктура известковой стенки различна у наиболее продвинутых представителей разных классов, представляющих особые филогенетические линии развития, и используется как диагностический признак высокого таксономического ранга. Раковина фораминифер обтекается снаружи слоем цитоплазмы, так что их скелет в строгом смысле не внешний, а внутренний.
Еще более важным признаком, на котором построена вся система фораминифер, служит строение раковины и ее камер. В простейшем случае раковины одно- или двухкамерные; у большинства многокамерных видов число камер не превышает 5—30, но есть высокоорганизованные формы с числом камер, достигающим нескольких сотен. В этих случаях камеры могут быть дифференцированы по форме и функции, что является высокой ступенью организации для простейших. Многообразие жизненных форм раковин фораминифер, типов их симметрии настолько велико, что делает эти организмы исключительной моделью для исследования основных принципов морфогенеза. У многокамерных форм возникают системы интеграции, позволяющие преодолеть разобщенность отдельных подразделений, — это столоны, внутренние устьевые системы, туннели и каналы. Последние имеют собственные известковые стенки и отличаются особой сложностью. В них циркулирует эктоплазма. Функцию каналов можно сравнить с таковой кровеносной системы, сосуды которой имеют твердые известковые стенки. Это уникальная организменная система высокого уровня, встречающаяся среди протистов только у фораминифер. Цитоплазматическое тело фораминифер находится в основном внутри раковины; наружу через специальные отверстия — устья выходит сеть тонких, анастомозирующих между собой гранулоретикулопо- дий, главные функции которых — передвижение и захват пищи. Ретикулоподии резко отличаются от широких лобоподий амеб; а тем более от жгутиков и ресничек. Они служат диагностическим признаком ранга типа и хорошо отличают фораминифер от других протистов.
Ядерный аппарат фораминифер также несет черты высокой организации и своеобразия: у них имеется многоядерность и ядерный дуализм, выражающийся в том, что ядра дифференцированы по строению и функции на вегетативные и генеративные. Ядра фораминифер претерпевают сложные изменения в процессе жизненного цикла, который характеризуется гетерофазным чередованием поколений. При этом гаплоидная и диплоидная фазы цикла составляют почти равные части. Классический двухфазный жизненный цикл фораминифер занимает обычно 1 год, а иногда и 2. Лишь у представителей низшего рода Allogromia он завершается за 8 ч (Grell, 1973; Lee et al., 1979). Известны случаи, когда после выхода молоди родительская особь еще продолжала существование. Вероятно, длительность годичных жизненных циклов фораминифер адаптирована к годовой цикличности обилия питательных веществ, цветения водорослей. Долгие периоды вегетативного существования требуют активности и жизненной стратегии, сравнимой с таковой многоклеточных организмов. В этом отношении фораминифе- ры — не очень типичные простейшие. Присущий им темп роста очень мал, а продолжительность жизни необычайно велика по сравнению с другими протестами.
Гаметы подавляющего большинства фораминифер имеют 2, редко 3 жгутика; иногда встречаются амебоидные, по-видимому утратившие жгутик. Митохондрии взрослых особей и гамет имеют трубчатые кристы.
Средний размер большинства видов 0.5 мм, масса отдельного организма 0.01—0.5 мг. Среди роталиел- лид и глабрателлид есть группы, отличающиеся более мелкими размерами — до 0.1 мм (Pawlowski, Lee, 1991). Большинство фораминифер едва различимы невооруженным глазом, но среди как вымерших, так и современных форм встречаются виды размером с монету (2—3 см) или даже с ладонь (12—16 см) (ископаемые нуммулитесы, современные корнуспирои- десы, палочковидные батисифоны). Это настоящие гиганты в мире простейших. Механизм функционирования таких крупных клеток, их ядерный аппарат до сих пор не изучены и представляют огромный интерес.
Подавляющее большинство видов фораминифер — донные формы, передвигающиеся по столонам водорослей, гидроидам, грунту, зарывающиеся в грунт на 2—10, иногда до 30 см (Goldstein, Harben, 1993), чаще свободноживущие, иногда прикрепленные, ложноколониальные. Прикрепленные формы разных, не родственных групп приобретают конвергентное сходство, приспосабливаясь к прикреплению и распространению по субстрату. Среди фораминифер известны комменсалы и очень редко — паразиты. Небольшая часть видов перешла к парению в верхней толще воды (преимущественно до 200 м) и приобрела глубокие адаптации к пелагическому образу жизни.
Фораминиферы практически всеядны, употребляют в пищу бактерии, дрожжи, водоросли, других протистов, мелких многоклеточных животных, их яйца и личинки, детрит, растворенную в воде органику. Но сами они редко становятся пищей для других организмов и их участие в пищевой цепи пока сложно оценить. В немногих известных случаях (заглатывание рыбами, иглокожими) фораминиферы использовались, скорее, как источник извести.
Фораминиферы — почти исключительно морские организмы, составляющие одну из наиболее важных групп океанического бентоса во всех районах Мирового океана — от литорали до абиссальных впадин. Небольшое число видов обитает в опресненных водах устьев рек, а также в грунтовых водах повышенной солености — в пустынях Африки и Средней Азии (Бродский, 1928; Gauthier-Lievre, 1935; Янковская, Михалевич, 1972; Михалевич, 1976). Биомасса донных фораминифер может составлять от 20 до 80 %, иногда превышая массу макробентоса. Их может быть так много, что они напоминают «живой песок». Фораминиферы, занимающие огромные пространства морского дна, представляют весьма значительный резервуар запасной энергий. Многие виды фораминифер служат индикаторами состояния водных масс — они могут указывать на загрязнение, а также на богатство питательными веществами, что, в свою очередь, может быть использовано для определенных районов перспективного рыбного промысла. У донных фораминифер-эпибионтов обнаружена специальная защитная система (Yanko et al., 1994). Ее состояние может использоваться как очень чувствительный биомаркер для предсказания экологических последствий в районах антропогенного загрязнения.
Отмершие раковины фораминифер участвуют в образовании морских осадков, составляя важнейший компонент толщи осадочного чехла Мирового океана на всех этапах его формирования. В осадках отлагаются не только донные, но и планктонные формы, отмершие раковины которых падают «дождем» на дно сквозь толщу морской воды со средней скоростью 2 см/с, образуя так называемые голубые, или глобигериновые, илы. Они занимают в Мировом океане примерно треть всего дна (около 120 млн км2); их толщина местами доходит до нескольких метров. В результате химических и тектонических процессов эти илы со временем превратились в известняки. Следовательно, фораминиферы являются их породообразующим элементом; входят они наряду с кокко- литофоридами и в состав мела. В меловом периоде фораминиферы благодаря своей активности стали основой известковых отложений в условиях недостатка СО2. Из-за этого воды океанов мира оказались насыщенными растворенным карбонатом кальция, который является активным поглотителем углекислого газа:
СаСО3 + СО2 —H2O—> Са(НСО3)2.
Бикарбонат, Са(НСО3)2, — хорошо растворимая соль, способная накапливаться в океане бесконечно долго, тем самым спасая планету от парникового эффекта и перегрева. Такова биосферная роль фораминифер, осуществляющих карбонат-бикарбонатное равновесие в природе (Михалевич, 1999).
Раковины фораминифер известны с кембрия; имеются отдельные сообщения о более ранних находках. Фораминиферы — единственная группа животных, ископаемые остатки которых столь полно представлены и изучены на протяжении всей геологической истории Земли. Это обстоятельство наряду с особенностями строения их раковин (в онтогенезе в основном последовательно повторяются черты строения предков) дает уникальный материал для изучения их филогении и построения их естественной системы.
Комплексы пустых раковин на дне океанов (та- натоценозы) отражают условия обитания живых комплексов и используются при палеореконструкциях прежних экологических условий, восстановлении очертаний палеоконтинентов. Фораминиферы незаменимы при определении возраста осадочных пород, в том числе нефтегазоносных. В связи с их огромной ролью при поиске энергетических полезных ископаемых в течение двух веков изучались преимущественно их раковины, а основные сведения о строении их живой клетки и биологические сведения получены лишь в конце нашего века.
История изучения
Первые упоминания о фораминиферах относятся к 5 в. до н. э., когда Геродот заметил в известняках египетских пирамид округлые, напоминающие монеты образования, позднее названные нуммулитами. В России в 18—19 вв. такие известняки называли «чечевичными» камнями, а известняки с удлиненными раковинами фузулинид, похожими на зерна, —- «хлебными» камнями. Леонардо да Винчи изображал в своих орнаментах мелких фораминифер, которых он рассматривал с помощью трубки с двумя увеличительными стеклами на концах — задолго до изобретения микроскопа. Сохранилось несколько изображений фораминифер, сделанных в 18 в. (Beccarius, 1731; Janus Plancus, 1739, — цит. по: Loeblich, Tappan, 1988), и более позднего времени, когда их рассматривали уже как живые организмы. В конце 18—начале 19 в. появляются первые научные работы, посвященные этой группе (Batsch, 1791; Soldani, 1789— 1798; Fichtel, Moll, 1798; Lamarck, 1801; Montfort, 1808; Фишер, 1829, — цит. no: Loeblich, Tappan, 1988). Первые классификации фораминифер, основанные на строении их раковин, даны в начале 19 в. (de Blainville, 1825; d’Orbigny, 1826, 1839, — цит. no: Loeblich, Tappan, 1988). Впервые название «фораминиферы» — несущие отверстия (форамены) — было введено д’Орбиньи. Он рассматривал их как класс, состоящий из 10 семейств, 5 из которых валидны до сих пор. Во всех вышеупомянутых работах фораминифер считали моллюсками, вплоть до работ Дюжардена (Dujardin, 1835, — цит. по: Loeblich, Tappan, 1988), отнесшего их к простейшим, к группе Rhizopoda, на основании наличия у них нитевидных разветвляющихся псевдоподий.Благодаря целому ряду последующих работ, посвященных морфологии и классификации фораминифер (Schultze, 1854; Carpenter, Parker, Jones, 1862; Reiss, 1862; Jones, 1875; Schwager, 1877, — цит. no: Loeblich, Tappan, 1988), было расширено представление об их составе и введено много новых таксонов. Швагер, Райс и особенно Шульце (Schultze, 1854; Reiss, 1862; Schwager, 1877, — цит. по: Loeblich, Tappan, 1988) уделяли большое внимание строению стенки раковин. Шульце придавал этому признаку даже больший диагностический вес, чем строению самой раковины; им же было положено начало изучению живой клетки этих простейших.
Новый этап в изучении группы ознаменовали работы английского исследователя Брэди (Brady, 1884, — цит. по: Loeblich, Tappan, 1988), основанные на обширных сборах современных форм на судне «Челленджер». Атлас рисунков Брэди с новыми определениями Баркера (Barker, 1964, — цит. по: Loeblich, Tappan, 1988) не утратил своего значения и в настоящее время, несмотря на то что объем видов Брэди понимал очень широко. Последующие классификации конца 19—начала 20 в. (Neymayr, 1887, 1889; Delage, Herouard, 1.896; Eimer, Fickert, 1899; Lister, 1903; Rhumbler, 1911; Schubert, 1921, — цит. no: Loeblich, Tappan, 1988) развивали систему, пред- , ложенную Брэди. Среди них наиболее оригинальны работы Румблера (Rhumbler, 1911) и Листера (Lister, 1903, — цит. по: Loeblich, Tappan, 1988); последний много внимания уделял изучению диморфизма раковин, которое связано с чередованием поколений, открытым ранее Мюнье-Шальма (Munier-Chalmas, 1880).
В первой половине 20 в. вышли одна за другой 3 классификации Кушмана (Cushman, 1925, 1927, — цит. по: Loeblich, Tappan, 1988; Cushman, 1948), модифицировавшего систему Брэди. Он довел число семейств фораминифер до 50, что вызвало бурную негативную реакцию европейских специалистов, называвших его систему «сумасшедшей классификацией». Тем не менее в течение нескольких десятилетий она служила основой всех систематических работ по этой группе и была более популярна, чем другие (Galloway, 1933; Chapman, Parr, 1936; Glaessner, 1945; Hofker, 1951; Sigal, 1952; Pokorny, 1958, — цит. no: Loeblich, Tappan, 1988). Из перечисленных работ наиболее оригинальным подходом отличались 2: в одной из них в основу выделения таксонов положено строение устья (Hofker, 1951), в другой — количество камер (Sigal, 1952). Число включенных в них семейств составляло соответственно 23 и 62.
Первая попытка обосновать систему фораминифер филогенетически принадлежит Неймайру (Neymayr, 1887, 1889, — цит. по: Loeblich, Tappan, 1988). Начиная с работ Кушмана, авторы предлагаемых систем уделяли этому вопросу значительное внимание. Но наиболее последовательный и глубокий филогенетический эволюционный подход, основанный не только на морфологии, но и на данных геологической летописи, характеризует систему, данную Фурсенко и Раузер-Черноусовой (1959) в «Основах палеонтологии». К сожалению, она не охватывала всего многообразия форм, поскольку включала лишь группы, которые были найдены на территории бывшего СССР.
Вторая половина 20 в. характеризуется началом и затем бурным расцветом электронно-микроскопических исследований стенки раковин фораминифер. Ряд работ в этой области стали классическими (Reiss, 1957, 1959, 1960; Reiss, Merling, 1958, — цит. по: Loeblich, Tappan, 1988; Towe, Cifelli, 1967; Hansen, Reiss, 1971a, 1971b; Bellemo, 1974a, 1974b; Hemleben et al., 1977; Leutenegger, Hansen, 1979; Be et al., 1980, и мн. др.). Первые шаги были сделаны Райсом (Reiss, 1957, 1959, — цит. по: Loeblich, Tappan, 1988), перестроившим на основании полученных данных систему роталиацей (Reiss, 1963). Ему принадлежит заслуга открытия биламеллярной стенки. Обнаружив у некоторых роталиацей биламеллярную стенку, он выделил их в особые таксоны, оторвав от других близких по морфологии групп. Этот же подход сохранился и в двухтомной классификации Лёблика и Таппан «Treatise» (Loeblich, Tappan, 1964), ставшей на четверть века настольной книгой всех фораминиферологов. Позже было доказано, что биламеллярную стенку имеют все роталиацей, а первоначально ее не удалось обнаружить у части из них вследствие методических трудностей. Разорванные первоначально близкородственные формы дискорбид и кассидулинид были вновь воссоединены. Хотя увлечение новыми данными уль- тратонкого строения стенки повлекло за собой и в ряде других случаев необоснованные таксономические изменения (например, разрыв форм с микрозернис- той и гиалиновой стенкой), в целом оно дало новый импульс развитию систематики группы и привело к резкому возрастанию числа выделенных новых таксонов различного ранга. В «Treatise» вошло 127 семейств, а к моменту переиздания этой классификации (Loeblich, Tappan, 1988) было описано еще 104 семейства, 207 подсемейств (из них только после 1980 г. — 40 семейств, 66 подсемейств, 173 рода).
Наряду с электронно-микроскопическими исследованиями продолжались исследования морфологии раковин в световом микроскопе. Работы Хоттингера (Hottinger, 1978, 1982) поражают своей ювелирной точностью и глубиной морфофункционального анализа. В классификациях второй половины нашего века сохранялись 2 направления: в первом придается первостепенное значение составу и структуре стенки раковин, во втором — плану строения раковин. Первое направление продолжали развивать Лёблик и Таппан ^Loeblich, Tappan, 1988) и их последователи. Хотя с некоторыми положениями их классификации 1988 г. нельзя согласиться, тем не'менее этот фундаментальный двухтомный труд, включающий все известные роды фораминифер, прекрасно иллюстрированный, с полной ревизией и синонимией всех родовых и надродовых таксонов остается до сего дня непревзойденным и значение его трудно переоценить. Однако, как справедливо полагает Хэйнс (Haynes, 1990), использование этой классификации в качестве стандарта и успехи прикладной палеонтологии иногда противостоят появлению новых вариантов системы, что, в свою очередь, может привести к ошибочным выводам в стратиграфии. Он приводит яркие примеры, когда разделение глобигеринид на Globogerinidae и Globorotaliidae помогло обнаружить резкие переломы в горизонтах мелового и четвертичного периодов. Сходная картина наблюдалась при разделении орбитальных фораминифер. «Перемены такого рода — яркий показатель здоровья науки, и жалобы по этому поводу напоминают таковые по поводу того, что Коперник разрушил стабильность птоломее- вой системы» (Haynes, 1990). Системы, предложенные отечественными исследователями (Подобина, 1978, 1998; Субботина и др., 1981; Саидова, 1981; Басов, 1990; Маслакова, 1990; Михалевич, 1992, 1998; Григелис, 1995; Раузер-Чер- ноусова и др., 1996), а также рядом зарубежных авторов (Hohenegger, Piller, 1975; Brasier, 1980, — цит. по: Lee, 1990; Hansen, 1979; Hohenegger, 1981, 1990; Jones, 1984, 1994), представляют второе направление. К сожалению, все они уступают по полноте охвата материала классификации Лёблика и Таппан.
Большая часть всех известных работ по форами- ниферам (до 70-х гг. нашего столетия) посвящена изучению их скелетов, чаще ископаемых. Библиография только по работам, касающимся систематики, настолько огромна (свыше 6000 названий), что одно упоминание авторов, внесших существенный вклад в изучение группы, составляет солидный список (см.: Loeblich, Tappan, 1988). Современная литература по группе почти необъятна. С начала 80-х гг. (см.: Haynes, 1981) и поныне ежегодно выходит более 500 работ. Поэтому особое значение приобретают каталоги. Наиболее известный из них начат еще в 1940 г. (Ellis, Messina, 1940, — цит. по: Loeblich, Tappan, 1988) и состоит к настоящему времени из 82 объемных томов. Кроме того, имеется «Индекс родов и видов фораминифер» (Sherborn, 1888, — цит. по: Loeblich, Tappan, 1988), переизданный Тальманом (Thalmann, 1960), и каталог планктонных фораминифер (Saito et al., 1976, — цит. по: Loeblich, Tappan, 1988).
В России микропалеонтологические исследования начаты петербургским профессором Меллером (1878, 1880, — цит. по: Фурсенко, Раузер-Черноусова, 1959). В 30—70-е гг. нашего века сложилась крупная школа отечественной микропалеонтологии, долгое время возглавляемая А. В. Фурсенко и Д. М. Ра- узер-Черноусовой, которая недавно отметила свой столетний юбилей выходом «Справочника по систематике мелких фораминифер палеозоя» (под ред. Вдовенко и др., 1993). Работы других крупных фораминиферологов этого периода (О. С. Вялова, А. М. Волошиной, А. А. Крашенинникова, М. С. Бараша, Т. Н. Горбачик, М. Н. Соловьевой, Е. А. Рейт- лингер, Л. Ф. Плотниковой, В. Н. Беньямовского, О. Богуш и др.) внесли огромный вклад в изучение систематики и стратиграфии ископаемых фораминифер различных регионов бывшего СССР и дна Мирового океана. Крупный центр этой школы сложился в Петербурге, во ВНИГРИ, выпустившем ряд монографий в серии «Ископаемые фораминиферы СССР» и «Микрофауна СССР» (Н. Н. Субботина, А. К. Богданович, Н. А. Волошинова, В. П. Василенко, Л. Г. Дайн, Е. В. Быкова, Е. В. Мятлюк), а также в «Трудах» ВНИГРИ, Геологического и Палеонтологического институтов АН СССР и ВСЕГЕИ. Эти исследования продолжают микропалеонтологи следующего поколения — С. П. Яковлева, В. А. Басов, А. Я. Аз- бель, Л. А. Алексейчик-Мицкевич, Э. М. Бугрова, Г. П. Пронина (к сожалению, эта школа в . настоящее время переживает большие трудности).
Стратиграфическое распространение крупных таксонов фораминифер и этапы их исторического развития освещены в работах как отечественных, так и зарубежных авторов (Фурсенко, Раузер-Черноусова 1959; Loeblich, Tappan, 1964; Раузер-Черноусова, 1972, — цит. по: Loeblich, Tappan, 1988; Но- henegger, Piller, 1975; Ross, Haman, 1989).
В 20 в. получили широкое развитие фаунистические, экологические и зоогеографические исследования современных фораминифер. В России это школы Зоологического института РАН, Санкт-Петербург (3. Г. Щедрина, В. И. Михалевич, Т. Г. Лукина), Института океанологии РАН, Москва (М. С. Бараш, X. М. Саидова, Н. В. Беляева, И. И. Бурмистрова, Т. А. Хусид) и некоторые другие (И. А. Басов, Л. В. Поляк — Институт Арктики и Антарктики, Санкт-Петербург). За рубежом наиболее значительны работы Бэнди (Bandy et al., 1964, 1965, — цит. по: Debenay et al., 1996), Болтовского (Boltovskoy, 1953—1984, — цит. no: Loeblich, Tappan, 1988), Би (Be, 1957—1982, — цит; no: Debenay et al., 1996), Флегера (Phleger, 1951, 1960, — цит. no: Debenay et al., 1996), Мюррея (Murray, 1963—1996, —: цит. no: Debenay et al., 1996), Кеннета (Kennet, 1976, — цит. no: Lee, Anderson, 1991), Дебенея с соавт. (Debenay, 1985—1996, — цит. no: Debenay et al., 1990—1998), а также Де Лака (De Laca et al., 1980) и Липса (Lipps, 1983). Позже были начаты (Lee et al., 1971; Seiglie, 1971) и успешно продолжены (Nagy, Alve, 1987; Alve, 1991; Yanko et al., 1994, 1998; Kaminski et al., 1995) исследования влияния загрязнений на фауну фораминифер прибрежных морей. Работа Бреслера и Янко (Bresler, Yanko, 1995) положила начало изучению химической экологии фораминифер.
Как уже указывалось, преимущественное внимание уделялось изучению скелета фораминифер, даже у ныне живущих форм. Их цитология, биология, жизненные циклы до сих пор изучены недостаточно. После первых шагов в этом направлении (Schultze, 1854; Munier-Chalmas, 1880; Lister, 1895; Rhumbler, 1911; Munier-Chalmas, Schlumberger, 1883, 1885; Schaudinn, 1894—1903, — цит. no: Loeblich, Tappan, 1988) в начале нашего века были выяснены более подробно жизненные циклы нескольких видов (Winter, 1907; Myers, 1935, 1936, 1940; Foyn, 1936; Jepps, 1942; Le Calvez, 1938, 1946, 1950, :—цит. no: Loeblich, Tappan, 1988). Важный вклад внесли классические работы Грелля и его учеников и ряд более поздних работ (Arnold, 1982, 1984; Lee et al., 1991; Goldstein, Moodley, 1993; Roettger et al., 1998; Stouff et al., 1999a).
Наиболее полно изучен на световом и электронно-микроскопическом уровне жизненный цикл Cibi- cides lobatulus (Воронова, 1976, 1978а, 19786, 1979) и Saccammina alba (Goldstein, Т988). Первые цито- фотометрические исследования ядер были проведены Вороновой и Селивановой (1976) и Цех (Zech, 1964). Электронно-микроскопические исследования жизненных циклов других видов пока фрагментарны (Dahlgren, 1967а, 1967b; Schwab, 1969, 1973, 1976; Angell, 1971; Cesana, 1971, 1972, 1975, 1978; Berthold, 1977; McEnery, Lee, 1981; Arnold, 1982; Pawlowski et al., 1995b; Goldstein, 1997).
Появился ряд работ и по жизненным циклам планктонных форм (Lee et al., 1965; Be et al., 1976; Spindler et al., 1978; Be, 1980). Конец века ознаменовался Серьезным изучением цитоплазмы фораминифер на^ электронно-микроскопическом уровне. Обобщающие сведения приведены в работах Андерсона и Би (Anderson, Be, 1978), Андерсона (Anderson, 1988), Ли (Lee, 1990, 1993) и Ли и Андерсона (Lee, Anderson, 1991). В результате всех этих исследований картина строения цитоплазмы фораминифер и особенностей их жизненных циклов (Anderson, 1984; Воронова, Михалевич, 1985; Lee et al., 1991) становится в общих чертах ясна.
Кроме того, имеется ряд работ, в той или иной мере посвященных биологии (Lipps, Ronan, 1974; Hallock, 1981а, 1986; Hickman, Lipps, 1983; Faber, 1991; Lee, Anderson, 1991, и др.) и питанию фораминифер (Muller, Lee, 1969; Murray, 1973; Lipps, 1975; Boltovskoy, Wright, 1976; Lee, 1980; Haynes, 1981; Brand, Lipps, 1982; De Laca, 1982; Alexander, De Laca, 1987; Faber, Lee, 1991a) и их взаимоотношениям с симбионтами (Hallock 1981b, 1982, 1984; Lee, Anderson, 1991). Особенно большой вклад в изучение проблем симбиоза внесли работы Ли с соавт. (см. работы 1963—1991 гг.), Андерсона и Би (Anderson, Be, 1976а, 1976b), Хоттингера (Hottinger, 1982), Леуте- неггер (Leutenegger, 1977, 1983, 1984). Наиболее широко все направления изучения фораминифер (цитология, симбиоз, экология, биология, физиология, питание, систематика и даже характеристика ДНК) представлены в работах школы Ли.
Исследование группы становится все более углубленным и всесторонним, начато изучение последовательностей нуклеотидов ДНК, протеинов, ассоциированных с минеральными элементами в стенке раковин (King, Hare, 1972; Schroeder, Bada, 1977; Langer et al., 1993; Lee, 1993, 1995; Wray et al., 1993; Stat- hoplos, Tuross, 1994; Pawlowski et al., 1995a), имеется попытка применения данных по аминокислотному составу нескольких современных видов и родов в таксономии (Haugen et al., 1989; Pawlowski et al., 1995a, 1997; Fahrni et al., 1997), появились первые биохимические работы (Schwab, Schlobach, 1973; Anderson, Be, 1976a; Schroeder, Bada, 1977; Laatsch, Schwab, 1984; Faber, Lee, 1991b; Bresler, Yanko, 1995). На излюбленном классическом объекте — Al- logromia laticollaris начаты физиологические исследования (Lee, Pierce, 1963; Schwab, Hofer, 1979).
Однако фораминиферы все еще представляют обширное поле для исследования: неизвестны внутреннее строение многих раковин, ультраструктура стенки некоторых крупных таксонов, жизненные циклы и строение цитоплазмы и ядер огромного большинства видов, особенно у нодозариат и текстуляриан; даже инвентаризация видов и родов фораминифер еще далека от завершения.
Морфология и физиология
ОСОБЕННОСТИ СТРОЕНИЯ СКЕЛЕТА ФОРАМИНИФЕР
Морфология раковины
Фораминиферы имеют однокамерную или многокамерную раковину, обтекаемую снаружи слоем цитоплазмы, так что скелет их в строгом смысле не внешний, а внутренний. Типы строения раковин чрезвычайно многообразны, именно они придают такое своеобразие всей группе. Основные типы скелета следующие:1) ветвящиеся, изогнутые или иной неправильной формы;
2) одноосные (камеры расположены в 1 или в 2—5 параллельных рядов);
3) неправильно- клубковидные (обороты навиваются беспорядочно) и правильно клубковидные (обороты располагаются под правильными углами друг к другу, угол зависит от числа камер в обороте и их расположения);
4) спирально свернутые (спираль может быть плоской — плоскоспиральные, конической — трохоидные или еще более высокой вытянутой формы, спирально-винтовые).
Свернутые раковины могут быть эволютными (снаружи видны все обороты спирали) и инволют- ными (последний оборот или даже одна последняя камера охватывает все предыдущие). Инволютность может быть частичной (снаружи видна лишь часть оборотов, часто одна сторона раковины инволютная, другая — эволютная (у трохоидных форм)).
Этими морфологическими типами не исчерпывается все морфологическое разнообразие раковин. Существуют гетероморфные типы, когда в процессе онтогенеза раковина начинает свое развитие по одному типу, а заканчивает — по другому, в результате чего она состоит из отделов разного строения. Например, начальный отдел может быть плоскоспиральным, поздний — выпрямленным (Ammobaculites, Ammotium, Lingulina, Amphicoryna, или начальный — трохоидный, поздний — 3-, 2- или 1-рядный (многие Ataxophragmiida). У милиолид часто начальный отдел клубковидный, поздний — спирально-плоскостной или выпрямленный. Во многих не родственных группах последние камеры часто располагаются циклически. Иногда в одной раковине последовательно сменяются 3 разных типа строения.
Гетероморфность может распространяться не только на способы расположения камер, но и на их форму, размеры, строение устья. Тип строения раковин (наряду с другими чертами их морфологии — строение устья, камер) мы считаем ведущим таксономическим признаком ранга класса; более частные детали их строения характеризуют отряды.
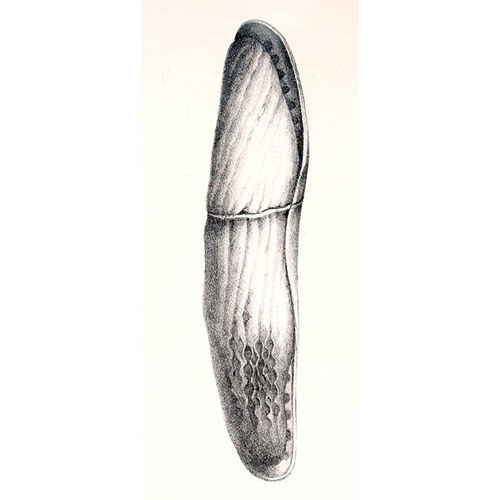
В случае двухкамерной или многокамерной раковины начальная округлая камера называется про- локулусом. У многих милиолят за пролокулусом следует вторая узкая трубчатая камера, образующая вокруг него полный или неполный оборот, — флек- состиль. Форма камер фораминифер чрезвычайно разнообразна — она может быть округлой, овальной, трубчатой, веерообразной, серповидной, трапециевидной, звездчатой, V-образной или иной. Как правило, она характеризует виды и роды, но в отдельных случаях специфична для таксонов более высокого ранга. Так, у милиолят преобладают трубчатые камеры различной длины; у спириллинат — длинные трубчатые камеры, образующие несколько оборотов; у астроризат обычны камеры ветвящейся или иной неправильной формы; у нодозариат встречаются камеры редкой V-образной формы. Внутренность камер может быть усложнена дополнительными структурами — сетчатыми или ячеистыми образованиями, столбиками, неполными перегородками, клапанами. Число камер чаще от 4—5 до 20—30, но может доходить до нескольких десятков и даже сотен. Камеры отделены друг от друга септами, при пересечении которых со стенкой раковины образуется шов. Швы могут быть на одном уровне с поверхностью раковины либо углубленными, выпуклыми, натечными; по форме они могут быть прямыми, косыми, в различной степени изогнутыми, иногда зигзагообразными.
Устье
Сообщение внутренней цитоплазмы раковин с наружной средой осуществляется через специальные отверстия — устья. Внутренние устья камер, предшествующих последней, обычно называют фораменами. В некоторых группах первичные фо- рамены зарастают, но во внутренней перегородке конвергентно образуются новые отверстия в другом месте, исполняющие ту же функцию, дейтерофорамены (Ceratobuliminidae). Устья могут быть единичными или множественными, занимать различное положение по отношению к последней камере (у ее основания или на вершине) и ко всей раковине (на пупочной или спиральной стороне, периферическом крае (редко). У вытянутых форм устье может быть конечным. У эволюционно продвинутых родов могут быть дополнительные устья, расположенные в швах на пупочной стороне (у трохоидных и некоторых плоскоспиральных форм), реже на периферических концах камер. Форма устьев разнообразна — округлые, овальные, петлевидные, щелевидные, ситовидные, древовидные, лучистые. Они могут быть усложнены дополнительными скелетными образованиями — как наружными (шейка, отворот, губа), так и внутренними (ребра, пластинки, зубы, желобки, трубки, устьевые камерки). Ребра, пластинки и зубы выполняют основную опорную функцию, так как расположены по ходу сильного тока цитоплазмы и наиболее развиты у вытянутых, удлиненных форм, достигая особенной сложности у милиолят, булиминид (роталиата), нодозариат. Так называемый пластинчатый зуб милиолят в отличие от их внутренних зубов относится к наружным образованиям, поэтому мы предложили назвать его устьевой лопастью (Михалевич, 1981). Строение устья может меняться в процессе онтогенеза (например, от единичного к множественному). Зуб милиолят может меняться от простого к сложному. Вообще внутренние зубы милиолят уникальны и достигают большой сложности и разнообразия. У агглютинированных форм, стенка которых в отличие от секреционной стенки не позволяет сформировать дополнительные опорные структуры, нередко опорную функцию несут включенные в состав приустьевой стенки спикулы губок. Все многообразие дополнительных образований устья связано с их большой и разноооб- разной функциональной нагрузкой в связи с усиленным движением цитоплазмы в устьевой области. У некоторых примитивных однокамерных форм с органической или агглютинированной раковиной (Lagynana, Astrorhizana) оформленное устье отсутствует.Различные черты строения устья имеют разный таксономический вес. Так, внутренние зубы милиолят характерны только для этого класса. Энтосолениевые трубки и радиальное устье нодозариат, имеющиеся у их агглютинированных (Nodosinum) и секреционных форм (Dentalina), — также важный диагностический признак ранга класса. Для представителей класса Rotaliata характерны сильно развитые, сложные зубные пластинки, желобки, клапаны, не встречающиеся ни в одном другом классе.
У планктонных форм (класс Globigerinata) устья сильно увеличены в размерах. Положение устья по отношению к последней камере в большинстве классов фораминифер конечное. Только в класcax Rotaliata и Globigerinata оно изначально базальное — в основании устьевой поверхности последней камеры. Положение устья по отношению к раковине часто используется в разных классах как признак семейственного ранга, а более мелкие особенности строения устья — в качестве родовых признаков. Так, многие роды в подклассах текстуляриана и роталиана и в классе глобигерината были выделены на основании наличия у них дополнительных устьев. В то же время способность образовывать дополнительные устья характерна лишь для некоторых классов.
Интегрирующие системы
У особей с большим числом камер и оборотов сообщение цитоплазмы отдельных камер между собой и с внешней средой становится затруднительным. Это противоречие снимается возникновением интегрирующих систем различной сложности.1. С т о л о н ы — у многокамерных форм система взаимосвязанных внутренних устьев большой протяженности (в классе Miliolata — у альвеолинид; в подклассах Textulariana — у высших литуолид, орбито- линид, Rotaliana — у орбитоидид).
2. Т у н н е л и — система просветов между внутренними перегородками (в подклассах Ammodiscana — у фузулинид, Miliolana — у альвеолинид). У первых они проходят между отложениями внутреннего скелета (хоматами) и резорбированными отверстиями в нижней части септ, у вторых — это система просветов, которые составляют спиральные перегородки, не доходящие до межкамерных септ. В обоих случаях они расположены между элементами внутреннего скелета (эндогенное происхождение), имеют органическую выстилку и, по существу, не имеют собственных стенок. Сходные происхождение и функцию имеют проходы между последовательными, расположенными одна над другой камерами конечного отдела у Rhapydionina (Miliolana). Токи цитоплазмы проходят в просветы между множественными устьевыми отверстиями и столбиками этих последовательных камер. Эти проходы неверно назывались в литературе каналами, но в отличие от последних они не имеют собственных стенок.
3. В н у т р е н н и е у с т ь е в ы е с и с т е м ы — внутренние образования устья; могут быть сильно развиты и проходить через всю камеру от устья к предыдущему форамену, соединяя последовательно между собой форамены всех предшествующих камер. Они получили большое развитие у Rotaliata, особенно в подклассе Rotaliana, встречаются у моноаксиальных Globigerinata, изредка — у Nodosariata(Михалевич, 1993а, с. 7).
4. К а н а л ы, — отличаются от столонов и туннелей морфологически (они экзогенного, а не эндогенного происхождения, проходят не внутри камер, а между ними) (Hottinger, 1978) и функционально — в них циркулирует не внутренняя, а наружная цитоплазма, которая доставляет к внутренним частям клетки кислород, осуществляет связь с внешней средой и отделена от внутренней цитоплазмы с помощью специальных образований, не имеющих, по современным данным, внутренней органической выстилки. При этом достигается высокая степень дифференциации цитоплазмы. Каналы можно рассматривать как сложный устьевой аппарат. Подобной уникальной системы нет ни в одной другой группе протистов. Системы каналов, развитые в различной степени, давно известны во многих семействах роталиат и могут рассматриваться как пример параллелизма в близкородственных группах. Обычно у них имеются спиральные и радиальные каналы с множеством более мелких разветвлений. Недавно описанные каналы у представителей подкласса Spirillinana являют пример параллелизма в более далеких таксонах. Они не достигают такой сложности, как каналы роталиан, в простейшем случае представляя систему щелей (например, Lasio- discidae). У более сложно организованных Hottingerellidae имеются спиральный канал и щелевидные проходы, связывающие его с полостью камер. Поскольку наличие каналов рассматривается как диагностический признак ранга отряда, среди спириллинан также были выделены соответствующие отряды.
Описанные выше интегрирующие системы — это системы нового, организменного уровня. Они позволяют снять разобщенность, нарастающую по мере увеличения числа камер, оборотов спирали и общих размеров раковин, ведут к более глубокой частичной или полной компартментализации и дифференциации цитоплазмы, повышают уровень организации клеточной системы.
Стенка раковин
ХИМИЧЕСКИЙ СОСТАВ
Органическая (тектиновая) стенка низших фораминифер (лагинаны) и органическая основа стенки всех остальных групп состоит в основном из мукополисахаридов и склеропротеинов. Наиболее детально ее состав изучен у Heterostegina depressa (Rotaliana) (Weiner, Erez, 1984). На долю протеинов приходится около 0.5 % ее массы. Составляющие стенку макромолекулы относятся к 2 основным классам веществ: в одном преобладают протеины, богатые аспарагиновой кислотой, в другом — протеины, богатые серином и глицином и, вероятно, связанные с полисахаридами. Биохимические свойства макромолекул матриц, обнаруженных у гетеростегины, подобны свойствам органических матриц других типов. Мукополисахаридная основа стенки (гликокаликс) играет барьерную роль, защищая организм от влияния загрязнений среды, что прослежено на биохимическом уровне (Biesler, Yanko, 1995).В состав агглютинированной раковины входят песчинки, спикулы губок и другой посторонний материал, скрепляемый вначале органическим, а затем минеральным цементом, который секретируется организмом (Bender, Hemleben, 1988). Появление сек- реционных известковых элементов можно объяснить экзоцитозом вакуолей, в которых известковые гранулы образуются в результате карбоангидразозависимого транспорта НСО3~ в сочетании с переносом Са++ (в вакуоль) в обмен на Н+ (в цитоплазму). В процессе участвует Са++/Н+ АТФ-аза, поскольку условием кальцинации является защелачивание вакуолярной среды (Лабас, Михалевич, 1987); вакуоли поставляются аппаратом Гольджи.
У подавляющего большинства фораминифер скелет известковый, чаще кальцитовый, реже арагони- товый, который, как правило, в силу особенностей своей кристаллической решетки более богат стронцием. Арагонитовый скелет известен для крупной группы робертинид, для ряда других групп — инво- лютинид, некоторых планктонных фораминифер (фавузеллиды) (Григелис, Горбачик, 1980; Горбачик, 1983, — цит. по: Loeblich, Tappan, 1988). Наличие арагонитового скелета, на наш взгляд, не является таксономическим признаком высокого ранга. У Trocho- lina (Involutinida) один из видов имеет кальцитовую раковину, другой — арагонитовую. У некоторых фораминифер наблюдались прослои кальцита и арагонита в одной раковине (Archambault-Guezou, Lefevre, 1981). Кроме того, в ископаемом состоянии арагонит легко переходит в кальцит. Поэтому мы сохраняем робертинид как самостоятельный таксон не потому, что стенка их раковин арагонитовая, а на основании морфологии их раковин. Известковый скелет включает небольшие примеси соединений Mg, Мп, Fe, Al, Sr и некоторых других элементов. Состав их изменчив, изучен недостаточно, однако высокая магнезиальность известковых игл милиолят может служить дополнительной характеристикой подкласса, а преобладание железистого цемента характерно для некоторых агглютинирующих видов и родов.
Среди фораминифер описан ряд агглютинирующих родов и 1 секреционный род Silicoluculinina с кремнеземной стенкой. Поскольку минеральный состав скелета определяется органической матрицей, а состав ее аминокислот у организмов с известковым и кремнеземным скелетом различен и строго специфичен для таксонов высокого ранга (фораминиферы, радиолярии, акантарии, хризофитовые, гаптофито- вые, диатомовые, губки и другие, — King, 1977), такие формы заслуживают выделения в самостоятельный таксон не ниже класса. Однако в связи с тем что секреторное происхождение кремнезема в стенке фораминифер, несмотря на работы Хансена и Ханзликовой (Hansen, Hanzlikova, 1974), все же не доказано окончательно, положение таких форм в системе остается проблематичным. Скорее всего, окремнение стенки раковин — результат вторичных процессов, идущих при фоссилизации. Как показал Голубев (1981), при разрушении органических пленок, окружающих кристаллы, последние становятся плохо растворимыми. Это имеет место не только при фоссилизации, но и при обжиге. Если рядом имеется кремнезем (например, прокаливание происходит на стекле), — кристаллы окремняются.
УЛЬТРАСТРУКТУРА СТЕНКИ РАКОВИН
За два последних десятилетия появились новые электронно-микроскопические исследования ультраструктуры стенки фораминифер (см. раздел «История изучения»).Агглютинированная стенка в простейшем случае состоит из зерен кварца, скрепленных тем же органическим веществом, что и подстилающий стенку слой. Тончайший слой этого вещества обволакивает каждую песчинку и может образовывать тонкие расслаивающиеся прослои между рядами песчинок. Эти прослои носят случайный, нерегулярный характер. Кроме песчинок в состав стенки фораминифер могут входить пустые раковины других организмов (в том числе и фораминифер), частицы слюды, спикулы губок и иной посторонний материал. Некоторые роды (JTechnitella) строят раковину исключительно из спикул губок. В условиях культуры, при отсутствии природного грунта, они используют любой доступный материал (осколки стекла, угля). Песчинки в стенке раковин могут располагаться в один или несколько слоев, быть сцементированы слабо, рыхло или твердо, прочно. Многие виды агглютинирующих фораминифер способны отсортировывать частицы по размерам (грубопесчанистая, тонкопесчанистая стенка), иногда в стенке раковин одного вида имеются слои, состоящие из частиц разного размера, разной степени сцементированности (например, у Rhabdam- mina parabyssorum внутренний слой твердый, наружный — рыхлый). Обычно более тонкопесчанистые слои находятся у внутренней части стенки и возле устья; наружные слои более грубые.
Наличие агглютинированной стенки мы используем как таксономический признак ранга подкласса; частные особенности ее строения могут служить родовыми и видовыми признаками.
Все многообразие описанных типов известковой секреционной стенки можно свести к нескольким основным типам.
1. М и к р о г р а н у л я р н а я с т е н к а (термин Раузер-Черноусовой и Герке, — см.: Раузер-Черноусова, Герке, 1971) — над ВОС беспорядочно и рыхло (не ориентированно) расположены довольно крупные (1—5 мкм) известковые зерна округлой, овальной, угловатой или иной формы. «Субангулярная, равнозернистая, разнозернистая» и т. д. типы стенок, описанные в литературе, — ее частные случаи. Каждое из зерен окружено тонкой органической оболочкой; более толстые расслаивающиеся прослои того же органического вещества встречаются беспорядочно и прерывисто между группами зерен, как и в случае агглютинированной стенки. Иногда зерна отсортированы по размерам. В световом микроскопе эта стенка выглядит шероховатой, сахаристой. Она встречается наряду с агглютинированной в подклассах Astrorhi- zana, Ammodiscana, Hormosinana, Textulariana. Между агглютинированной и микрогранулярной стенками нет резкой границы — часто встречаются формы со смешанным типом. Среди 142 агглютинированных видов, изученных Бендером (Bender, 1995), формы с известковым цементом составляли 21%. Поскольку некоторые агглютинированные виды могут сами секретировать известковые зерна, можно предположить, что переход в эволюции от агглютинированной стенки к микрогранулярной происходил постепенно. Поэтому мы не придаем микрогранулярной стенке такого высокого таксономического веса, как это принято в системах Лёблика и Таппан (Loeblich, Tappan, 1964; 1988) и их последователей.
Агглютинированная и микрогранулярная стенки во многом сходны. Очень часто они массивные, толстые, тяжелые. Дополнительные элементы скелета, усложнения стенки возникают при этих типах почти исключительно внутри раковин (сетчатые, ячеистые, губчатые, альвеолярные слои, столбики, группы сливающихся столбиков, холмики, хоматы.
2. И г о л ь ч а т а я (ф а р ф о р о в и д н а я) стенка милиолят — над ВОС расположен известковый слой удлиненных кристаллов 3 различных способов укладки: толстый рыхлый срединный слой из беспорядочно пересекающихся длинных игл (иногда в виде коротких цилиндрических кристаллов) либо планок, облицованный изнутри и с поверхности плоскими плитчатыми кристаллами, уложенными параллельно поверхности наподобие паркета. Именно наружному «паркетному» слою обязаны высшие милиоляты фарфоровидным блеском в световом микроскопе. Он нередко бывает разрушен, и тогда стенка теряет, свой блеск, становясь тусклой, шероховатой. Каждый из кристаллов, как и в предыдущем типе стенки, имеет тонкую органическую оболочку. Электронно-микроскопические исследования низших представителей милиолят — шлумбергеринан с агглютированной стенкой (Михалевич и др., 1986) также позволили обнаружить у них известковые секретированные элементы, характерные для стенки высших милиолят (длинные иглы на внутренней стороне стенки и зуба, короткие толстые палочки в срединном слое стенки. Этот факт наряду с полным морфологическим сходством (квинквелокулиновый тип строения раковин, строение устья и зуба) свидетельствует о родстве этих групп, обоснованности выведения их из состава текстуляриат (Саидова, 1981), а также о том, что, как и в случае с микрогрануляр- ной стенкой, переход от агглютинированного типа стенки к секреционному совершался в эволюции этих групп постепенно. Полное сходство строения этих раковин ранее рассматривалось как конвергентное, в действительности они представляют разные этапы в эволюции группы. В отличие от микрогранулярной Стенки при игольчатой стенке на наружной стороне раковин может возникать разнообразная скульптура (ячеи, ребра, шипики). Нередки при этом типе стенки и внутренние столбики (например, у Shanita, Archaias).
3.Стекловато-лучистая, или радиальная (но не часто употребляемый термин «радиально-лучистая»!), стенка нодозариат — расположенные над ВОС удлиненные столбчатые кристаллы (скорее всего, образованные более мелкими кристаллитами), которые окружены тончайшей органической мембраной и ориентированы перпендикулярно поверхности стенки; между ними остаются отверстия размером 1—1.5 мкм (псевдопоры). У начальных камер раковин четко выражены слои нарастания. В световом микроскопе стенка выглядит стекловатой (лягены, нодо- зарии, лентикулины). Этот тип стенки исследован недостаточно.
У современных нодозариат описана моноламел- лярная стенка; у некоторых древних форм (пермь, триас) стенка также моноламеллярная, у ряда других (Eonodosaria, Eogeinitzina) описан внутренний мик- рогранулярный слой й наружный радиальный (Губенко, 1989). Возможно, первый является следствием перекристаллизации. Во всяком случае, в процессе исторического развития он исчезает. У современных фораминифер сочетание микрогранулярного и радиального слоев не отмечалось. Процесс возникновения третьего типа стенки менее ясен, однако она отличается от микрогранулярной упорядоченным ориентированным расположением столбчатых кристаллов и существенно отличается от биламеллярной стенки роталиат, описанной ниже. При этом типе стенки встречены почти исключительно наружные дополнительные скелетные образования (ребра, шишки, шипы); внутренние септы только у вымерших Colaniellidae.
4.Уникальный тип секреционной известковой стенки представляет монокристаллическая сек- реционная стенка высших спириллинан. Она исследована недостаточно. По-видимому, кристаллы расположены очень тесно, упорядоченно, строго перпендикулярно ВОС и, вероятно, в один слой, в результате чего могут вести себя оптически как единый кристалл или 2—3 кристалла. Слои нарастания не обнаружены. Как видно, у Patellina corrugata (Berthold, 1976) она покрыта не только изнутри, но и снаружи тонким органическим слоем. У ископаемых форм нередко отмечен внутренний гранулярный известковый слой (например, у Archaediscus), возможно, возникший в результате диагенеза. У современных спириллинан такой слой отсутствует. В световом микроскопе этот тип стенки выглядит стекловатым, часто скульптурирован снаружи. Он обладает высокими структурными возможностями, так как у некоторых представителей этой группы (например, у Lasiodiscida, Hottingerellida) обнаружена даже система каналов, хотя и довольно примитивная (Hottinger, 1976; Азбель, 1986).
Перечисленные выше 4 типа секреционной известковой стенки образуются по одну сторону от ВОС, во всяком случае, у слабо изученных 3-го и 4-го типов СОМ (см. ниже) пока не обнаружена. Оба этих типа проявляют во многом сходные свойства. Так, кристаллы наружных ребер Nodosaria af- finis вели себя как несколько крупных кристаллов (Hay et al., 1963). В обоих таксонах сильно развита способность к образованию ламелл, многократно окружающих всю раковину с каждым этапом роста (ортол амеллярность).
5.Принципиально иное строение имеет била- меллярная (=бифонтинальная, — см. ниже) стенка роталиан и глобигеринат. Часто в русскоязычной литературе ее называют двухслойной. Наиболее наглядно ее строение изображено в классической работе Хемлебена с соавт. (Hemleben et al., 1977). Кроме подстилающего раковину снизу ВОС у них имеется второй срединный органический слой (мембрана) — COM (primary organic membrane). По обе стороны от нее одновременно закладываются и затем формируются внутренний и внешний известковые слои. При этом считалось, что функция матрицы переходит от ВОС к СОМ. Внутренние септы также сразу закладываются двойными. Внутренний известковый слой ниже СОМ сохраняет постоянную толщину на протяжении жизни особи. По мере роста раковины кнаружи от СОМ количество нарастающих дополнительно слоев может быть различным, толщина их неодинакова. Они также разграничены дополнительными органическими мембранами (органическими слоями — ос). Мы предлагаем закрепить за ними как термин выражение «слои нарастания». Они формируются при многократном участии обтекающего раковину наружного слоя цитоплазмы. Вновь образованные слои простираются над всеми предыдущими камерами, в результате стенка предшествующих камер толще, чем у последующих (в особенности, чем у самой последней). Наибольшего развития эти дополнительные слои достигают у планктонных форм, образуя мощную корку («crust»). Этот тип стенки имеет тонкую единообразную упорядоченную структуру: мельчайшие кристаллиты, окруженные тончайшим слоем органического вещества, объединены в небольшие плитки (plates), уложенные друг над другом в вертикальные столбики перпендикулярно поверхности стенки. В световом микроскопе стенка выглядит прозрачной, гиалиновой, в отличие от бесцветной стенки нодозариат она часто слабо-желтоватая или розоватая, по-видимому благодаря большему присутствию органических прослоев. Если столбики направлены не перпендикулярно к поверхности раковины, а под косым углом (35°, 45°), причем направление угла наклона меняется то в одну, то в другую сторону, стенка теряет блеск и прозрачность и становится матовой. (Зернистая и гиалиновая стенки часто встречаются у видов одного рода, например у Turrilina (Hansen, 1972)). Такую стенку называли микрозернистой. Выделение таксонов высокого ранга на основании наличия микрозернистой стенки привело к разрыву в системе близкородственных групп (см. раздел «История изучения»). Иногда в стенке одной и той же раковины имеются участки с перпендикулярными и косыми столбиками, например у Globorotalia (Маслакова, 1978).
Дополнительные скелетные образования при этом типе стенки достигают особого разнообразия и сложности — внутренние клапаны, пластинки, желобки, системы каналов у роталиан, наружные ребра, шишки, шипы, иглы, а также прикрывающие пупок или швы дополнительные скелетные пластинки роталиат и глобигеринат, не встречающиеся в других классах. Может быть, внешняя скульптура раковин действительно иногда придает стенке большую прочность, как считалось ранее, однако чаще всего ее расположение и направление указывают на связь с интенсивными токами цитоплазмы в том же направлении (Hemleben, 1975; Hemleben et al., 1977), а бугорки и кили могут служить местом прикрепления ретикулоподий. Длинные толстые сплошные шипы некоторых донных форм не гомологичны внешне похожим на них шипам Calcarina, Baculogypsina и Baculogypsinoides, внутри которых проходят каналы. Не гомологичны они и иглам планктонных форм, служащим опорой рети- кулоподиям и растянутой на иглах цитоплазме, приспособленной к парению (Hastigerina). Еще более специализированное образование — иглы Globi- gerina, которые могут быть закреплены подвижно наподобие сустава в выступах, имеющих углубление в центре, и при необходимости могут поворачиваться либо сбрасываться во врегёя опускания раковин на дно. Внешние концы этих игл слабо либо вовсе не кальцифицированы, благодаря чему они становятся гибкими и не ломаются.
Пятый тип стенки возникает в результате появления центров секреции по обе стороны от СОМ в виде одновременно закладывающихся 2 пластин. Мы называем такую стенку бифонтинальной (Михалевич, 1992, 1995, 1999), что позволяет противопоставить ее первым четырем типам стенок, которые образуются в виде одного слоя над ВОС и относятся к монофонтинальному типу (прежнее название «однослойная» приводило к смешению понятий, так как в монофонтинальной стенке могут присутствовать слои разного генезиса, например слои с зернами, отсортированными по размерам, слои нарастания).
Существует еще один, особый тип стенки — у картерин. В ней крупные уплощенные овальные и веретеновидные известковые зерна уложены в 1 слой параллельно поверхности раковины и скреплены органическим цементом с примесью мельчайшего агглютинированного материала. Поскольку пока неясно, секретируются ли эти зерна самим организмом или взяты извне, систематическое положение этого выделенного нами отряда (Михалевич, 1980, 1999) окончательно не установлено.
Между основными перечисленными типами стенки имеются различия в способе секреции извести. Стенка милиолят образуется в результате гетерогенной нуклеаций кальцита (редчайшее явление среди всех живых организмов). Стенка пателлин и, по-ви- димому, остальных спириллинат образуется по особому, безматричному типу как следствие постепенного разрастания на конце трубчатой камеры и по наружному краю раковины, а не с поверхности, как у других групп с известковым скелетом. Микрограну- лярная, нодозариевая радиальная и бифонтинальная стенки возникают по эпитаксиальному типу (на органической матрице) в результате поляризованной секреции. При этом если переход от органической стенки к агглютинированной и от нее к микрогранулярной и милиолятной мог совершаться постепенно и, по-видимому, также постепенно мог произойти переход от микрогранулярной к радиальной стенке (по сообщению Исаковой, у фузулинид наблюдались округлые зерна, уложенные в столбики, перпендикулярные поверхности раковины, — Михалевич, 1992, 1999), то бифонтинальная стенка роталиат могла возникнуть лишь в результате резкого, скачкообразного изменения характера секреции — появления второго центра секреции и одновременной закладки 2 пластин (Лабас, Михалевич, 1987).
Из всех перечисленных выше типов стенки наиболее древними являются тектиновая и агглютинированная, возникшие еще в докембрии. Известковая микрогранулярная стенка, а также стенка нодозариан и спириллинан возникли в девоне, карбоне, милио- лян — в карбоне, перми. Наиболее поздно сформировалась стенка роталиан — в триасе, юре; расцвет организмов с этим типом стенки начался с мелового периода. Фораминиферы представляют собой уникальный объект для изучения процессов биоминерализации, эволюции скелета на протяжении геологической истории.
Строение пор
Предложенное еще в прошлом веке деление фораминифер на перфората и имперфората (Carpenter et al., 1862) многими авторами принимается до сих пор и входит в диагнозы многих таксонов. Тем не менее стенка всех фораминифер в той или иной мере проницаема и имеет разнообразные мелкие отверстия. Их можно обнаружить даже у раковин с органической стенкой. Характер поровых отверстий тесно связан с типом стенки. У агглютинированных и микро- гранулярных раковин это либо случайные неоформленные просветы между зернами агглютината или секретированной извести, либо тонкие, нередко извитые канальцы с органической выстилкой (у некоторых текстулярий), либо ветвящиеся или ампулообразные, более крупные полости й канальцы в стенке фузулинид и высших атаксофрагмиид, либо прямые короткие тонкие канальцы («canaliculi») некоторых астроризат (Masonella, — 547,1, Astrorhizana, 7), ли- туолид и атаксофрагмиид.Собственно, всю систему щелей и альвеол в толстой губчатой микрогранулярной стенке можно рассматривать как способствующую обмену с внешней средой. Все эти полости чаще замкнуты с какой-либо одной стороны, но проницаемость стенки обеспечивается просветами между частицами и проницаемостью самих органических мембран. Все эти детали строения используются в систематике фораминифер, однако мы (Михалевич, 1980, 1981, 1992, 1999) придаем им меньший таксономический вес, чем Лёблик и Таппан (Loeblich, Tappan, 1988), которые выделили раковины одинакового строения, но с наличием или отсутствием небольших поровых канальцев в микрогранулярной и агглютинированной стенках в крупные, далеко отстоящие друг от друга таксоны (например, гомеоморфные Prolixoplectidae и Eggerellidae). Мы рассматриваем эти особенности строения как тесно связанные с особенностями микрогранулярной стенки в целом.
Прямые, очень узкие поровые канальцы без дополнительных поровых пластинок (ситовидная поровая пластинка в основании отмечена) существуют и при стекловато-лучистом (радиальном) типе стенки. Органическая внутренняя выстилка в канальцах при этом типе стенки пока не обнаружена. Поровые отверстия спириллинан исследованы недостаточно. Наиболее подробно они изучены у Patellina corrugata (Berthold, 1976). Это довольно широкие, воронкообразные углубления, снаружи напоминающие ямки. Их боковые стенки выстланы тонким органическим слоем, снизу они замкнуты ситовидными пластинками с очень мелкими микропорами (0.01 мкм), их внутренняя полость заполнена гранулированным органическим веществом. Стенка милиолят описывается как неперфорированная. Однако мы наблюдали отдельные, неравномерно разбросанные, неправильной формы отверстия на поверхности раковины Borelis pulchra, а также у некоторых агглютинированных милиолят (Михалевич, 1983; Михалевич и др., 1986). У пене- роплиса даже отмечены неправильные и разветвляющиеся поровые канальцы. Известны поры и у некоторых триасовых и верхнепермских милиолят (Milioli- porinae, Kamuraninae). У одного из видов Nubeculina из голоцена Кларк (Clark, 1993) наблюдал регулярные поровые отверстия на внутренней, более тонкой и плотной части стенок, слепо заканчивающиеся в более толстом рыхлом наружном слое, имеющем ти- пичное для милиолят строение. Мы сталкиваемся здесь с таким же явлением, как у многих астроризан и тек- стуляриан с толстой стенкой: поровые канальцы сформированы лишь частично, в остальной части стенки проницаемость обеспечивается более рыхлым расположением ее структурных единиц. У большинства милиолян функцию пор заменяют просветы между рыхлыми кристаллами. Во всех описанных выше случаях мы имеем дело с псевдопорами. Собственно поры имеются только в бифонтинальной стенке — обычно это равномерно расположенные, цилиндрические неветвящиеся поровые канальцы с собственной органической выстилкой вдоль стенок, толстой губчатой поровой пластинкой с ситовидными отверстиями (микропорами) на уровне СОМ и более тонкими пластинками на уровне последующих органических слоев (Hemleben et al., 1977; Leutenegger, 1977; Spindler, 1978). Число поровых пластинок и микропор пока не может быть использовано в диагностических целях в силу неполноты данных. Среди роталиан наиболее крупные поры отмечены у дискорбид (у Discorbis vesicularis — 2—2.5 мкм), а также у Robulus midwayensis (0.5) и Bulimina margi- nata (0.25—0.5 мкм). У планктонных форм (Globigerinata) размеры пор обычно крупные (у Globigerina bulloides размер воронкообразных пор 0.5 мкм в нижней части, 2 мкм — в верхней, расширенной части). Псевдопоры нодозариан более мелкие (рис. 536, 5): размер овальных пор у Nodosaria qffinis — 0.16 мкм в ширину, 0.33 мкм в длину. Размеры пор в разных отрядах нодозариан и роталиан служат лишь вспомогательным диагностическим признаком. У планктонных форм наружная часть пор резорбируется, исчезают вторичные поровые пластинки, входное отверстие расширяется до воронкообразного (рис. 535, 4, А), напоминая «щели» в капсулярной мембране радиолярий (конвергентное сходство структур у планктонных организмов). Перед процессом гаметогенеза поры многих планктонных фораминифер запечатываются вторичными отложениями извести и перестают функционировать (Be et al., 1980). Особое строение пор у глобигеринат — таксономический признак ранга класса. В настоящее время известно, что поровые пластинки проницаемы для О2, СО2, ионов солей, растворенных низкомолекулярных органических веществ, благодаря чему поры играют важную роль в процессах дыхания, осморегуляции, поддержания ионного равновесия клетки с окружающей средой и в некоторых других процессах метаболизма. Они избавляют клетку от излишней герметизации. У многих донных видов (Nonionella Stella, Buliminella tenuata, Bolivina argentea, Cassidulina cornuta и др.) возле пор обнаружены скопления митохондрий и симбиотических водорослей (Leutenegger, Hansen, 1979; Hottinger, 1982), что подтверждает дыхательную функцию пор. Поры играют и защитную роль, препятствуя проникновению бактерий. До работ Бертольда (Berthold, 1976) о функции пор судили главным образом на основании их морфологии. Бертольд провел оригинальный эксперимент: через отверстие тонкой аллюминиевой пластинки в морскую воду была опущена раковина Patellina cor- rugata вершиной конуса вниз. Более широкое основание возвышалось над пластинкой; находящееся на нем устье было запечатано силиконовым маслом и парафином. Единственными отверстиями раковины оставались погруженные в морскую воду поры. Растворенный в воде краситель нейтральный красный активно проникал через поры; спустя некоторое время его концентрация в раковине намного превысила таковую в воде. Сквозь прозрачную стенку раковины были видны циркулирующие потоки цитоплазмы, свидетельствующие о том, что клетка жива. Наблюдения в световом микроскопе (Myers, 1935) позволили сделать вывод о том, что поры, как и устье, служат местом выхода ретикулоподий. Однако уже Ле Кальве (Le Calvez, 1947) и Арнольд (Arnold, 1954), а впоследствии и другие ученые (Towe, Wright, 1963; Sliter, 1974; Berthold, 1976; Leutenegger, 1977) показали, что поры закрыты изнутри либо органическим слоем, либо ситовидной пластинкой и никак не могут служить местом выхода псевдоподий. Последние могут выходить лишь через устья и отверстия каналов. У некоторых планктонных фораминифер (Ог- bulina), не имеющих одного главного устья, в стенке раковины находятся мелкие поровые отверстия и между ними более крупные, обеспечивающие выход псевдоподий. Последние в отличие от пор на самом деле являются устьями (Berthold, 1976).
Цитология и физиология
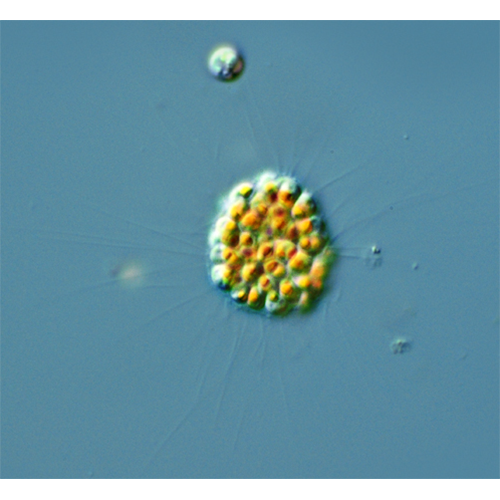
Новые данные по ультраструктуре клетки фораминифер уже могут быть частично использованы в систематике.У живых особей цитоплазма обычно ярко окрашена: желтовато-зеленоватая, коричневатая, бурая, оранжевая, бордовая, что зависит от содержащихся в ней различных включений и водорослей. В период размножения она очищается и становится прозрачной или молочно-белой. Резкие механические, химические, температурные и световые воздействия заставляют животное быстро втянуть свою цитоплазму внутрь раковины. При этом освободившиеся последние камеры заполняются жидкостью из сжавшихся вакуолей, которая, возможно, играет защитную, буферную роль между организмом и окружающей средой. У большинства фораминифер нет постоянной четкой границы между эндо- и эктоплазмой. Лишь у высших форм, имеющих систему каналов, в которых циркулирует эктоплазма, это разделение становится постоянным. Наружный слой цитоплазмы обтекает тонким слоем раковину донных форм, у планктонных он образует более мощный слой, а у Hastigerina — специализированную пузыристую капсулу, напоминающую калимму радиолярий.
РЕТИКУЛОПОДИИ
От наружного слоя цитоплазмы отходит сеть тонких, обычно ветвящихся и анастомозирующих между собой нитей — ретикулоподий (псевдоподий). Эта сеть — ретикулум — у донных форм может быть приподнята или растекается по субстрату веерообразно, у сидячих форм может распространяться широкой полосой (ламеллоподии), у планктонных она отходит радиально во все стороны, окутывая раковину «облаком». Диаметр ризоподиальных нитей от 30 нм до 1—2 мкм (у планктонных тоньше), длина их в несколько и даже в десятки раз превышает размеры раковин. В вытянутых ретикулоподиях наружная часть их цитоплазмы — реоплазма — совершает быстрый ток в двух противоположных направлениях (Allen, 1964) со скоростью до И мкм/с (Samuel et al., 1984). В ней содержатся мелкие гранулы (0.5 х 5 мкм), придающие ретикулоподиям зернистый вид (из-за чего их часто называют гранулоре- тикулоподиями), плотные темные частицы (возможно, источник фосфолипидов) и ряд еще более мелких частиц, среди которых имеются частицы, организующие движение (MOV — motility organizing vesicles). Они окружены фибриллярным материалом (Bowser, Rieder, 1985; Bowser et al., 1985). Могут встречаться в реоплазме и митохондрии, и лизосомы. Внутренняя, осевая часть ретикулоподий — стереоплазма — более темная и плотная, состоит из пучка микротрубочек, протянувшихся вдоль ретикулоподий. Микротрубочки могут иметь 1—2 коротких поперечных отростка (Febvre-Cheva- lier, 1971; Travis, Bowser, 1986), связывающих их друг с другом, и не могут образовывать таких сложных пространственных структур, как мультивалентные микротрубочки в аксоподиях радиолярий. Поперечные отростки (мостики) связывают микротрубочки и с другими окруженными мембраной органеллами, и с клеточной мембраной. Механизм движения (Travis, Bowser, 1991, — цит. по: Lee, Anderson, 1991) осуществляется следующим образом: динеин превращает свободную энергию гидролизата АТФ в механическую работу, позволяя микротрубочкам вращаться друг за другом подобно храповику; от вращающихся микротрубочек движение передается связанной с ними цитоплазме. Этот сложнейший процесс нуждается еще в дополнительных исследованиях.У планктонных фораминифер на поздних стадиях онтогенеза ретикулоподии становятся жесткими, перестают анастомозировать, приобретая некоторое конвергентное сходство с аксоподиями других планктонных протистов (солнечников, радиолярий, акантарий). Внутрь их врастают известковые иглы. Фораминиферы и здесь пошли по своему особому пути: во всех случаях, когда возникает необходимость в жестких структурах, у них формируются не органические, а минеральные известковые образования (иглы, раковины).
Ретикулоподии — важный систематический признак типа фораминифер, резко отличающий их от жгутиковых, инфузорий, амеб. Функции ретикулоподий многообразны: передвижение, захват пищи, осязание, образование новых камер, цист, оболочки вокруг сизигиев (см. раздел «Общая характеритика»). Комплекс псевдоподий в устье раковины называют подостилем. Вытянутые концы ретикулоподий прилипают к субстрату. В результате сокращения ретикулоподиальных нитей раковина подтягивается к месту прикрепления. Нужна немалая сила, чтобы подтянуть таким образом крупные раковины или удержаться на субстрате, водорослях, не быть снесенным током воды. При передвижении необходима способность к ориентации: упавшие с водорослей животные могут находить обратный путь на то же место (Zmiri et al., 1974). У некоторых мелководных видов наблюдался положительный термотаксис и отрицательный фототаксис. У форм, имеющих каналы, устье обычно зарастает (открываясь вновь только перед процессом образования новой камеры) и ретикулоподии выходят наружу через отверстия каналов — через «заднюю дверь», по образному выражению Хоттингера (Hottinger, 1982). Это дает животному возможность сохранять мобильность и при втянутой цитоплазме, уходить от вредных химических воздействий, ставить раковину на киль, поворачивая к свету боковые поверхности (что важно в случае наличия симбионтов): Мы наблюдали, как донная Massilina secans и другие виды милиолид прикрепляются ретикулоподиями к поверхностной пленке воды в чашке Петри, устьем кверху, и «плавают» в таком положении иногда по нескольку дней в поисках пищи. У некоторых видов раковина движется вперед, увлекаемая сильным током цитоплазмы. У М. secans она движется в сторону, противоположную той, куда направлены ретикулоподии, — как бы пятится задом. С помощью ретикулоподий фораминиферы могут передвигаться по плоскому субстрату, проходя 11— 188 мм в день (Wetmore, 1988). Laticarinina paupera- ta проходила 12—16 мм в день по поверхности грунта и 5 мм в день, передвигаясь в грунте (Weinberg, 1991). По нашим наблюдениям, Massilina secant продвинулась за 1 мин на 100 мкм, затем за 15 мин одолела расстояние длиной 215 мкм. При своем продвижении она оставляла хорошо заметные следы светлого органического вещества на дне чашки Петри. Во время передвижений по водорослям у фораминифер- эпифитов Textularia bocki и Quinqueloculina ungeria- na по всему пути их следования ретикулоподии оставляли следы из секретируемого ими органического вещества (предположительно, сульфатсодержащих гликозаминоглюканов), служащего питательной средой бактериям и грибам (Langer, Gehring, 1993). Последние, в свою очередь, служат пищей названным фораминиферам. Целенаправленное повторное возвращение фораминифер-эпифитов к своим «фермам» возможно на основе хемотаксиса. Таким образом, взаимоотношения фораминифер-эпифитов и водорослей приносят двустороннюю выгоду: водоросли зависят от организмов, очищающих их поверхность, а фораминиферы используют эту поверхность как источник пищи. Вещества, выделяемые отмершими разлагающимися водорослями, уменьшают вредное влияние загрязнений (в том числе тяжелыми металлами) на фораминифер (Bresler, Yanko, 1995).
Кроме функций передвижения (до 2 см в день) и прикрепления ретикулоподии способны осуществлять захват мелких частиц или отдельных организмов. Фабер и Ли (Faber, Lee, 1991а) даже называют их «аппаратом для захвата пищи». Ретикулоподии разветвляются по дну, проникая в интерстициальные пространства между частицами грунта на глубину 2—3 мм либо образуя в толще воды приподнятую над раковиной сеть. В последнем случае они нуждаются в поддержке. Эту функцию у сидячих донных видов осуществляют приподнятые разветвления раковин, иногда расположенные возле устья иглы губок; у многих планктонных видов — это длинные скелетные иглы (см. раздел «Секреционная известковая стенка»).
Выбор, захват и перемещение пищи могут включать сложные манипуляции (Anderson, 1988) — вращение, передачу от одной ретикулоподии к другой, поднятие на вершину псевдоподиальных нитей. Прикасаясь к добыче снаружи, ретикулоподии увеличивают давление, и поверхность жертвы (рачки, домики диатомей) лопается в наиболее слабых местах, подобно орешку. Тогда отдельные нити проникают внутрь и отделяют мягкие внутренние части, вылущивая содержимое из панциря таким образом, что создается впечатление точных и сложных осмысленных действий. Затем они переносят кусочки пищи в пищеварительные вакуоли, находящиеся внутри раковины или в ретикулуме. Обратным током цитоплазмы непереваренные частицы, имеющие вид серовато-коричневых шариков, выносятся к вершинам псевдоподий и выбрасываются во внешнюю среду. Избирательное отношение к пищевым частицам при кратком соприкосновении, вероятно, обеспечивается хемосенсорны- ми процессами (Anderson, 1988). У Massilina secans в культуре мы наблюдали, как убитые клетки Chlorella втягивались животным в ретикулоподии. В тонких нитях эти включения выглядели как вздутые узелки и перемещались цитоплазматическим током в сторону устья с большой скоростью — примерно 20—25 мкм/с. Возле устья они собирались в комок, превышающий диаметр устья (Михалевич, 1999).
Имеются сведения (Schultze, 1854; Christiansen, 1971), что ретикулоподии некоторых видов фораминифер (например, Elphidium) способны выделять парализующее жертву вещество: когда пойманное животное (быстро движущиеся копеподы, капреллиды, кумацеа или медленно движущиеся иглокожие, амебы) прилипает к нитям ретикулоподий, оно долго борется, судорожно пытается вырваться, но постепенно слабеет, окончательно запутывается в липких нитях и погибает. Картина, заснятая на пленку, выглядит драматично. Некоторым животным удается вырваться, но они падают на грунт и беспомощно шевелят лапками, неспособные к прежнему движению.
Своеобразно добывание пищи агглютинированной Pilulina argentea. Она выстраивает в глубине грунта домики (Christiansen, 1971) — полости, стенки которых выложены изнутри крупными песчинками, а сверху, на уровне поверхности грунта, закрыты «крышей» из ила и грязи. Домики в 3—4 раза крупнее самой раковины животного. Пилулина выставляет сквозь «крышу» ретикулоподии и поджидает добычу. Схватив какого-нибудь мелкого рачка, неосторожно подплывшего к колеблющимся нитям, она затаскивает его внутрь домика. Когда домики вскрывали, в них обнаруживали протиста, крепко держащего свою жертву. Есть предположение, что ретикулоподии фораминифер выделяют вещества, возможно, привлекающие либо парализующие животных. Так, Dunaliella прекращала движение, достигнув ретику- лоподиальной сети аммонии (Rotaliana) (Lee et al., 1961).
Фораминиферы могут быть хищниками и поедать других фораминифер. Floresina высококонической многокамерной раковиной (Rotaliana) заползала на превосходящие ее по размерам линзовидные раковины 3 видов Amphistegina (Rotaliana), проделывала до 10 отверстий в их стенке и извлекала цитоплазму из нескольких камер. Через 3—7 дней жертвы обычно погибали, но некоторые из них, после того как фло- резина откреплялась, восстанавливались. Иногда Amphistegina удавалось отразить нападение хищника (Hallock, Talge, 1994). Флорезины нападали только на взрослые раковины, на поверхности которых они затем размножались.
Отдельные сведения, накопленные по питанию фораминифер в культуре, и полевые наблюдения (см. с. 534, 537) показывают, что питание фораминифер разнообразно. Они могут использовать растворенные в воде аминокислоты и другие органические вещества (например, Notodendrodes antarcticus — De Laca et al., 1981; Pararotalia spinigera и Rosalina macropo- ra, — Bresler, Yanko, 1995), могут быть детритофага- ми, бактериофагами (обычно ниже освещенной зоны), поедать экскременты, водоросли (преимущественно диатомовые, но также дуналиеллу, хлореллу и др.), дрожжи, различных простейших, яйца, личинок, мелких рачков (например, копеподы Calanoida — главный компонент в питании глобигеринид). Некоторые виды питаются избирательно, но большинство, по-видимому, всеядны. Известны случаи каннибализма — поедания собственных зигот у Glabratella огпа- tissima (Myers, 1940), Patellina corrugata, Heterotheca lobata (Grell, 1988).
Каждый из способов питания может осуществляться активно (передвижение, увеличение токов воды движением псевдоподий) или пассивно. Пассивный тип питания особенно характерен для сидячих форм либо укрепившихся, «укоренившихся» в грунте. Приподнятые над поверхностью дна формы улавливают детрит, оседающий из толщи воды. Раковины могут лежать на поверхности грунта (Astrorhiza) либо передвигаться в его поверхностном слое, оставляя в нем ходы, чаще на глубине 1—2 см. В последнем случае раковины обычно удлиненной формы, при которой грунт оказывает наименьшее сопротивление (рабдаммины, ре- офаксы, многие милиолиды).
Распределение пищи влияет на многие стороны жизни фораминифер: наступление полового размножения, размеры, распространение. Так, планктонные виды с иглами поглощают преимущественно зоопланктон, а без игл — фитопланктон (Hemleben, Spindler, 1983). Последние точно повторяют в своем движении смещение максимума хлорофилла вверх и вниз между 0 и 95 м, а также уменьшение и исчезновение фитопланктона в высоких широтах. Эта картина четко отражается в современных и ископаемых осадках. Сезонность чередования поколений у донных фораминифер тоже нередко связана с обилием пищи, цветением водорослей.
Фораминиферы могут быть эпифитами на водорослях (чаще всего на Enteromorpha, Zostera, Zaniche- На, Ulva, Polysiphonia, Laminaria, редко на Fucus и Codium, — Lee et al., 1969; на Sargassum natans, — Spindler, 1980), эпибионтами на раковинах моллюсков, панцирях рачков, гидроидах (Dobson, Haynes, 1973), полихетах (мы наблюдали Cibicides grossepun- ctatus на элитрах антарктической полихеты Picnogo- пит sp.), других фораминиферах. На створках Chla- mys opercularis в Ирландском море был обнаружен 51 вид фораминифер-эпибионтов, причем часть из них были нехарактерны для этого местообитания (Harward, Haynes, 1976). Иногда фораминиферы сами служат подвижным субстратом для других животных, как например Buccella frigida для некоторых турбеллярий (Zapata, Varela, 1981).
Кроме того, фораминиферы могут быть комменсалами. Cibicides refulgens соскребает с раковины гребешка водоросли и бактерии. В то же время особи этого вида образуют над собой агглютинированные трубки и выпускают через них ретикулоподии, питаясь как фильтратор (Михалевич, Воронова, 1985); кроме того, растворяя раковину моллюска, С. reful- gens паразитически использует его аминокислоты (Alexander, De Laca, 1987). Случаи паразитизма среди фораминифер единичны. Planorbulina может быть эндопаразитом других фораминифер (Banner, 1971), Rosalina паразитирует на двустворчатых моллюсках (Todd, 1965). Все эти паразитические формы относятся к подклассу Rotaliana. Известны еще 2 случая паразитирования фораминифер из подкласса Nodosariana: Fissurina и Lagena (первый выкусывает гранулки в ретикулоподиях Discorbis mediterranen- sis, — Le Calvez, 1947).
Многие животные (рыбы, иглокожие) заглатывают фораминифер (Daniels, Lipps, 1978). Мелким видам гастропод (Walker, 1971) и полихет (Lipps, Ronan, 1974) и их молодым стадиям фораминиферы могут служить пищей. Они, скорее всего, используются не как источник калорий, а как источник СаСО3, но один из видов скафопод может вытягивать цитоплазму фораминифер из раковин наружу. Нематоды пробуравливают раковины фораминифер, их популяции быстро растут на фораминиферовой культуре. Некоторые гастроподы, являясь избирательными хищниками, могут существенно влиять на численность поедаемого вида (например, на численность Islandiella islandica). Другая гастропода, Litto- rina littorea, также пробуравливает раковины фораминифер (Walker, 1971). Нередки ископаемые раковины со следами хищников (округлые отверстия в стенке раковин).
Ретикулоподии принимают также активное участие в формировании новых камер. Этот процесс изучен у Discorbis (Le Calvez, 1938), Rosalina floridana (Angell, 1979), Clavulina (Coleman, 1980), Trochammi- na inflata (Angell, 1990), Textularia candeiana (Bender, 1992). У последней он протекает следующим образом. Перед образованием новой камеры организм усиленно питается. Последующий процесс можно разделить на ряд стадий.
1. Выход веера ретикулоподий через устье, последней камеры, который затем несколько укорачивается и формирует вокруг себя цисту из плотно упакованных частиц детрита, не скрепленных цементом, из-за чего циста может быть легко разрушена.
2.Формирование внутри цисты, перед устьем последней камеры, полости примерно такого же размера, как будущая камера, которая определяет пространство для ее построения.
3.Отбор частиц грунта для построения новой камеры и распределение их по всему фронту выступа в направлении от предпоследней камеры к устью с одновременным цементированием их органическим веществом и образованием наружного органического слоя (=оболочки — envelope).
4.Отложение биоминерализованной извести, в направлении от дистальной к проксимальной части стенки камеры. Ориентированное расположение кристаллов, формирующее цилиндрические полости поровой системы.
5.Органическая выстилка пор.
6.Формирование тонкого органического слоя с внутренней стороны камеры после того, как животное покидает цисту; затем наращивание этого слоя в несколько рядов в течение последующего роста.
Таким образом, у многокамерных агглютинированных раковин текстуляриан, а также хормозинан слои нарастания имеются, но только в органической части стенки (Bender, 1995). Весь процесс длится 24 ч.
Textularia относятся к подклассу Textulariana класса Rotaliata. У высших представителей этого класса в подклассе Rotaliana процесс формирования новой камеры наиболее подробно на современном уровне изучен у Rosalina floridana (Angell, 1979). Он тоже длится 24 ч. Начальные стадии — образование веера ретикулоподий, цитоплазматического выступа, совпадающего по очертаниям с формой будущей камеры, и цисты протекают так же, как у Textularia. Затем формируется «мембранный комплекс» цитоплазматического выступа, по-видимому, соответствующий наружной органической оболочке (envelope) у Textularia. Формирование цитоплазматического выступа завершается образованием мембраны. Она, по- видимому, и представляет собой СОМ, поскольку в отличие от Textularia у Rosalina floridana, как и у всех представителей с бифонтинальной стенкой, кристаллы извести откладываются по обе стороны от мембраны.
Начало и завершение процесса кальцификации прослежено Анжел (Angell, 1979) наиболее подробно. Сначала мелкие кристаллиты видны как мириады мелких темных точек, затем — как более крупные и светлые центры кристаллизации. В световом микроскопе на этой стадии на поверхности образующейся камеры видны разбросанные белые крапинки. Примерно через час после их появления становится видимым и устье будущей камеры. Постепенно центры кристаллизации увеличиваются в размерах, края их сливаются. Но между этими заполненными известью пространствами остаются незаполненными поровые полости. По-видимому, на поверхности цитоплазматического выступа предсуществует химическая «разметка» плазматической мембраны на зоны, участвующие в образовании извести, и «островки», в пределах которых это образование отсутствует, — будущие поры (Лабас, Михалевич, 1987). Равномерность расположения и упорядоченность центров секреции определяется, по-видимому, аппаратом Гольджи. «Пятнистый» характер известковой секреции, ее отсутствие в области пор можно предположительно объяснить паттерном зон экзоцитоза везикул, в мембране которых функционирует карбоангидраза и Ca++/H+ АТФ-аза. В работе Анжел дальнейший процесс не прослежен, однако, по-видимому, в данном случае, как и у Textularia, формируется органическая выстилка пор и ВОС. Раковинообразующая секреция извести и мукополисахаридная секреция органических элементов разделены во времени, по очереди сменяя друг друга (Лабас, Михалевич, 1987). Наконец, ретикулоподии выходят из устья новой камеры, разрушая цисту. Процесс образования ВОС над цитоплазматическим содержимым заканчивается в каждой камере позже, когда уже идет образование следующей (Spindler, 1978). Таким образом, расположение новых камер определяется положением фо- раменов, отражающих направление цитоплазматического потока, а их форма контролируется длиной и расположением ретикулоподий, которые формируют первую наружную органическую оболочку (envelope) — матрицу последующей кальцификации. Выход цитоплазмы за пределы камеры и образование новой камеры осуществляются циклически, с определенной периодичностью, у молодых чаще и быстрее, чем у взрослых. Одновременно помимо формирования последней камеры появляются новые органический и известковый слои на предшествующих камерах. Так возникают слои нарастания (см. раздел «Секреционная известковая стенка»). При этом в области пор на уровне новых органических слоев у донных бифонтинальных форм формируются дополнительные поровые пластинки.
Возникновение новых камер у планктонных видов (глобигеринат) имеет некоторые особенности (Hemleben, 1969; Towe, 1971; Spindler, Roettger, 1973). Они не строят цисту, у игольчатых форм первичная органическая мембрана натягивается, как тент, между известковыми иглами. Затем по обе стороны от нее происходит отложение извести, как у донных роталиат.
Формирование новых камер в классе Miliolata, прослеженное у Spiroloculina hyalina (Angell, 1980), принципиально иное. Хотя сначала перед появлением новой камеры их ретикулоподии тоже строят цисту, она, однако, окружает всю раковину, а не только будущую камеру. После образования цисты в ней остаются ретикулоподии и через устье предыдущей камеры выходит небольшое количество цитоплазмы. С этого момента и начинается построение новой камеры. В отличие от Rosalina и Textularia у Spiroloculina до начала секреции новой камеры не формируется ни цитоплазматический выступ, ни окружающяя его оболочка (мембрана — envelope). Цитоплазма спиролокулины поставляет к месту образования стенки два рода вакуолей: с органическим веществом (иногда наблюдались уплощенные фибриллы) и с удлиненными кристаллами извести. Как те, так и другие вакуоли (пузырьки) открываются и одновременно опорожняются в пространство, образующееся между тонким слоем цитоплазмы и ретикулоподиями. Так формируется довольно толстая органическая матрица, в которую внедряются известковые кристаллы (у роталиат кристаллы извести отлагаются на мембране, а не внутри нее). Тонкий слой цитоплазмы формирует наружную часть стенки, затем ретикулоподии достраивают ее изнутри, тоже поставляя органические и известковые компоненты. Причем камера формируется не сразу вся целиком, как это имеет место у роталиат, а сегментами. Сначала движущийся поперек предыдущей камеры тонкий слой цитоплазмы формирует часть камеры, внедряя иглы беспорядочно, затем наращивает ее вперед; процесс продолжается вплоть до завершения построения камеры и формирования зуба. Псевдоподии добавляют новые элементы изнутри также последовательно, после того как тонкий участок стенки уже сформирован цитоплазмой снаружи. На этом этапе кристаллы укладываются ориентированно — параллельно поверхности стенки. Стенка постепенно утолщается. Далее ретикулоподии завершают построение каждого последовательно сформированного сегмента стенки появлением изнутри толстой мембраны (органического слоя, подстилающего стенку), отличающейся по составу и плотности от органического матрикса, в который внедрены кристаллы извести. Каждый кристалл имеет тонкую органическую оболочку, сохраняющую форму кристалла и хорошо различимую после его растворения. Известковые иглы имеют 0.2 мкм в длину и 0.01 мкм в ширину.
Во время образования последней камеры к ранее сформированным камерам продолжают добавляться новые порции органического и известкового материала, в результате чего начальные камеры становятся толще последующих, но слои нарастания не образуются. В ретикулоподиях, достраивающих стенку раковины, не просматривается почти никакой структуры — только пузырьки с органическим и известковым веществом. Ретикулоподии, прикрепляющие раковину к цисте, имеют множество продольных микротрубочек и филаментов. С их помощью после завершения формирования новой камеры раковина поворачивается в цисте и выходит из нее. На построение цисты уходит несколько часов; от момента выхода цитоплазмы из устья камеры до полного построения новой камеры проходит еще 6 ч.
По-видимому, у разных видов и родов милиолид этот процесс несколько варьирует. По нашим наблюдениям, циста при построении новой камеры у молодых мелких милиолид окружала всю раковину, а у крупных массилин обычно закрывала раковину лишь частично. Иногда животное выходило из цисты раньше, чем завершалось построение новой камеры, и окончание процесса было хорошо видно: бесформенная масса цитоплазмы в месте построения нового участка клубилась подвижным «облаком» (Михалевич, 1999; активность псевдоподий в этот период была велика, и раковина часто меняла положение — буквально поворачивалась с боку на бок. Вновь выстроенная камера тонкая и прозрачная (Михалевич, 1999). Пока построение новой камеры не завершено, границы последовательно сформированных сегментов отчетливо различимы, так как наиболее молодые участки отличаются и наибольшей тонкостью и прозрачностью. Построение камеры под цистой происходило за 8 ч, без цисты процесс иногда длился до 2 дней.
У представителей класса Spirillinata (на примере Patellina corrugata) процесс роста стенки камеры также совершается при участии ретикулоподий; образование цисты не наблюдается, рост ограничивается краями стенки трубчатой камеры; началу процесса кальцификации не предшествует образование цитоплазматического выступа. Морфогенетические процессы и в этой группе фораминифер глубоко отличаются от таковых у роталиат. Первыми формируются ближайшие к устью структуры, а не удаленные от него, строительный материал добавляется по краю уже имеющегося, как при строении обычной стены в высоту. Но и в этом случае, по-видимому, должен действовать механизм секреции, благодаря которому происходит поочередное отложение то извести, то органического вещества, образующего внутренний и внешний слои раковины и выстилку пор.
Таким образом, у рассмотренных представителей, относящихся, по нашей системе, к 3 разным классам (Rotaliata, Miliolata, Spirillinata), механизм роста и образования новых камер имеет глубокие различия и характеризует особые эволюционные линии развития (Михалевич, 1999). Мы считаем, что сходство процессов формирования новой камеры у Textulariana и Rotaliana подтверждает родство этих групп и опровергает общепринятые взгляды об их конвергентном происхождении, так как различий (формирование СОМ и откладывание извести по обе стороны от нее у роталиан) у них меньше, чем сходства (построение цисты только вокруг вновь строящейся камеры; формирование цитоплазматического выступа и окружающего его органического слоя; поочередное, а не одновременное, как у милиолят, откладывание извести органического вещества; формирование новой камеры сразу целиком и не от устья, а навстречу ему).
Механизм роста раковин и камер может нарушаться в экстремальных условиях: при сильных механических воздействиях, при крайних, почти летальных значениях температур, солености. Например, дисковидные соритиды в этих условиях могут становиться цилиндрическими или выстраивать полудиск, перпендикулярный основному; камеры правильно-клубковидных милиолид начинают нарастать беспорядочно, принимать уродливую, изогнутую форму — т. е. теряется тип симметрии, свойственный данному виду. Причиной этого является дезорганизация цитоплазматического тока. Но иногда разрушенная с одной стороны раковина достраивается до первоначальной формы. Все это заставляет предположить наличие механизма контроля роста, регулирующего формирование камер по оси симметрии и закрепленного генетически. По-видимому, это регулирование определяется биохимическим градиентом первичных мембран, покрывающих цитоплазму и ретикулоподии.
ЦИТОПЛАЗМАТИЧЕСКИЕ ОРГАНЕЛЛЫ
Основные цитоплазматические органеллы. Митохондрии, которые у фораминифер бывают до 0.5 мкм в диаметре и 1—5 мкм в длину, имеют трубчатые кристы. Пероксисомы (микротельца) обычно заполнены темной гранулярной массой и отмечены как у донных, так и у планктонных фораминифер. Диктиосомы аппарата Гольджи выделяют карбогидразу, а также слизь, которая транспортируется в пузырьках к поверхности раковины и к ретикулоподиям и служит для прикрепления к различным поверхностям, а иногда для удержания жертвы. Вакуоли с кристаллами извести для построения скелета, энзимы, в том числе пищеварительные, лизосомы (пищеварительные вакуоли) также секретируются в аппарате Гольджи. Переваривание пищи происходит, по-видимому, не только в этих вакуолях, но и непосредственно в цитоплазме (лакунах) (Leutenegger, 1977). Основные запасные питательные вещества в клетке фораминифер находятся в виде жировых капель. Обнаруженные у некоторых видов (Archaias angulatus, Cyclorbiculina compressa) зерна крахмала являются результатом деятельности симбиотических водорослей. ЭПР у фораминифер хорошо развит. Кроме того, в цитоплазме фораминифер встречаются ксантосомы (пигментированные гранулы), кольцевые мембраны (скорее всего, резервный материал для построения ядерных мембран в процессе размножения, — Spindler, Неш- leben, 1982). Есть органеллы, которые встречаются только у планктонных фораминифер, — это криптосомы (Lee et al., 1965) и микровилли (Anderson, Be, 1976а, 1976b; Leutenegger, 1977). Первые имеют округлую или неправильную форму , размером 15—30 мкм; иногда занимают более половины камеры; ассоциируются с углеводами. Роль их неясна. Система микровиллей (фибриллярный, или везикулярный, ретикулум) — уникальный механизм плавучести. Это изогнутые, разветвленные, плотно упакованные в вакуолярном пространстве трубки до 10 мкм в диаметре. По-видимому, замена тяжелых ионов легкими меняет удельную массу микровиллей, обеспечивая раковинам медленное вертикальное движение (Hansen, 1975).СИМБИОЗ
У многих крупных, секретирующих известь донных фораминифер, обитающих на глубине 10—70 м (Alveolinidae, Soritidae — Miliolana; Amphisteginidae, Calcarinidae, Nummulitidae — Rotaliana), и планктонных фораминифер эуфотической зоны (Globigerini- dae, Hastigerinidae, Globorotaliidae) в цитоплазме находят клетки водорослей (преимущественно динофлагелляты и диатомовые, но также хризофиты, родофиты, хлорофиты и, по-видимому, гаптофиты). У представителей Nonionida и Elphidiida найдены отдельные хлоропласты (Lopez, 1979). Часть этих водорослей — комменсалы и паразиты, но, как правило, какой-либо один вид является симбионтом для определенного вида фораминифер. В настоящее время симбионты обнаружены более чем в 20 семействах в 3 разных классах этих протистов. Многие группы близкородственных фораминифер связаны с одними и теми же или близкородственными симбионтами. У роталиат симбионты принадлежат только к диатомовым, у милиолят (Peneroplidae, Archaiasinidae) — к родофи- товым и хлорофитовым. Сходство симбионтов нуммули- тид (роталиаты) и альвеолинид (милиоляты) рассматривается как исключение (Leutenegger, 1984). Потребности симбионтов к различной освещенности влияют на распределение их хозяев по глубинам. Во время бесполого размножения дочерние особи наследуют симбионтов от родительской клетки, после полового процесса выбирают их из окружающей среды. У Hastigerina depressa симбионты менялись по сезонам. Клетка хозяина предоставляет симбионтам постоянную среду обитания и продукты питания, например азотистые соединения. Внутриклеточные диатомовые по сравнению со свободноживущими содержали повышенные количества глюкозы и глицерина (Kremer et al., 1980). Хозяин, в свою очередь, получает продукты фотосинтеза и питательные вещества (углеводороды, некоторые аминокислоты, например глютамин, аланин). Такие взаимоотношения особенно выгодны в среде, бедной пищевыми продуктами (Lee, 1980). Кроме того, вся система симбионт—хозяин получает дополнительную энергию. Возможно, различные организмы канализируют эту энергию по-разному. У исследованных фораминифер она резко увеличивает скорость кальцинации и, вероятно, производство органических мембран. По данным Хэллок (Hallock, 1981b), скорость кальцинации у симбионтсодержащих фораминифер возрастает вдвое. Радиоуглеродным методом (Kuile, Erez, 1987) доказано использование НСО3-симбионта при построении скелета фораминифер. Гипотетически результат этих процессов можно выразить следующей формулой: Са++ + 2НС0з----->кальцификация фотосинтез-----> СаСОз + СО2 + Н2О.Amphistegina lobifera может иметь запас углерода, полуденного на свету, откладывать его в специальных вместилищах и затем расходовать постепенно. Милиоляты таких запасов не делают и в отличие от симбионтзависимой амфистегины используют полученный углерод немедленно. В клетке хозяина симбионты обычно окружены тонкой мембраной, мешающей вторжению лизосом, но в условиях голода, особенно в темноте, фораминиферы переваривают их. У родофициевых — симбионтов пене- роплиса такая мембрана отсутствует; они свободно лежат в цитоплазме хозяина, что может рассматриваться как более продвинутая фаза симбиотических отношений (Lee, 1990).
Днем симбионты находятся в наружной цитоплазме, ночью— внутри раковин. Удаление симбионтов вызывает тот же эффект, что и темнота: сокращение продолжительности жизни и уменьшение размеров раковин.
Симбиотические отношения сложились у фораминифер в процессе длительной эволюции и повлияли на размеры и форму раковин, их внутреннюю морфологию (усложнение, появление большого числа камер и камерок), строение стенки (появление более тонких, прозрачных участков — «окон», частичная резорбция органического вещества). Эти изменения способствовали более удобному размещению симбионтов, наибольшей светопроницаемости. Сходные морфологические изменения раковин ископаемых форм дают основание предполагать также и у них наличие симбионтов (фузулиниды).
Положение симбионтов внутри протиста зависит от формы раковины хозяина. У билатерально-симметричных форм, стоящих на периферическом крае раковины и поворачивающих боковые стороны к свету под большим или меньшим углом (Amphistegina, Elphidium, Heterostegina), симбионты находятся на обеих сторонах раковины, у плоских форм, лежащих одной стороной на субстрате (Sorites), — на верхней стороне раковины. В обоих случаях симбионты располагаются в периферической части камер; часто их наблюдали возле пор.
Интересно размещение симбионтов у некоторых планктонных видов, имеющих иглы: ночью симбионты (динофлагелляты) находятся внутри раковин, но с рассветом покидают ее и размещаются вдоль игл в псевдоподиальной сети хозяина (Be et al., 1977).
Присутствие симбионтов влияет на изотопный состав раковин (фракционирование О18 и С13).
Кроме симбионтов в цитоплазме фораминифер найдены паразитические Sporozoa (Nyholm, 1962).
ЯДРО
Размеры ядер фораминифер варьируют от очень мелких (5—12 мкм) до более крупных (40—100 мкм) и очень крупных (0.6 мм у гигантских раковин Bathysiphon). Число хромосом известно для небольшого числа видов, оно невелико — 2, 3, 9, 18. Ядра имеют типичное для эукариот строение. Количество и размер ядерных пор варьируют у разных видов и, кроме того, зависят от физиологического состояния клетки. У многих однокамерных агглютинированных видов ядерная мембрана утолщена снаружи или изнутри фиброзным или губчатым (сотовым, сетчатым) слоями (например, у Boderia albicollaris), более жесткая. Более тонкая и эластичная оболочка ядер многих высших секреци- онных фораминифер позволяет изменять форму ядра и не препятствует их проникновению через узкие проходы из камеры в камеру. Их ядра чаще бывают не только округлой, но и лопастной, четковидной, амебоидной (термин см.: МсЕпегу, Lee, 1976), неправильной, причудливой формы. Ядро молодого гамонта Elphidium ponticum имело округлые очертания, зрелого — лопастные (Райков и др., 1998; Михалевич, 1999). У низших однокамерных фораминифер также наблюдались ядра гамонта амебоидной формы (Allogromia laticollaris, Myxotheca arenite ga,— Schwab, 1971). По-видимому, такая форма возникает у них из предшествующей округлой в процессе гаметогенетических изменений ядра, как это было прослежено у Allogromia laticollaris (МсЕпегу, Lee, 1976) и у Saccammina alba (Goldstein, 1988).В длинной трубчатой камере Quinqueloculina sp. мы наблюдали удлиненное, вытянутое вдоль камеры крупное ядро (Михалевич, 1999). У некоторых видов оболочка ядра с внешней стороны образует выросты (ворсинки), складки, извилины (Ovammina ораса, Globigerinoides sacculifer), что, по мнению Дальгрена (Dahlgren, 1967а), ведет к увеличению поверхности ядра и усилению его функций. Гистохимические исследования ядер фораминифер пока немногочисленны (Lee et al., 1965; Dahlgren, 1967b; Schwab, 1971; Воронова, 1976, Spindler et al., 1978; Райков и др., 1998, и некоторые др.). Они позволили обнаружить внутри ядер скопления хроматинового вещества (ДНК) и нуклеолы — обычно более темно окрашенные и крупные гранулы, содержащие белок и РНК. Скопления ее молекул часто видны снаружи от ядерных пор. Нуклеолы могут быть разбросаны по всему ядру или скапливаться на его периферии. Видимо, их расположение и размеры меняются при изменении физиологического состояния ядра. Хроматин в неделящихся ядрах обычно деконденсирован.
С тех пор как были впервые описаны 2 типа ядер у фораминифер (Grell, 1956) — вегетативные (или соматические, или Ма) и генеративные (или Ми), количество известных видов с ядерным диморфизмом значительно увеличилось (см.: Lee et al., 1965; Воронова, 1976, 1978а; Muller-Merz, Lee, 1976; Leutenegger, 1977; Grell, 1979; и мн. др.). В настоящее время стало ясно, что в процессе эволюции фораминифер произошла полимеризация ядер и их дифференцировка на соматические, контролирующие функции обмена, и генеративные, дающие начало новому поколению по классификации Райкова (1978), — большие пузырьковидные и малые пузырьковидные ядра). В соматических ядрах в 3 раза больше РНК и протеина, чем в генеративных, а количество ДНК в тех и других одинаково. Дифференцировка соматических ядер необратима. Генеративные ядра могут превращаться в соматические в случае утраты последнего.
Все обнаруженные к настоящему моменту виды с ядерным дуализмом относятся, по принятой нами классификации, к 2 родственным классам Rotaliata и Globigerinata и к своеобразному по строению раковин и ультраструктуре их стенки классу Miliolata. Данные по последнему классу весьма скудны, но обнаружение соматических и генеративных ядер у эволюционно продвинутого рода Sorites (S. marginalise •— Mtiller-Merz, Lee, 1976; S. orbicularis, — Leutenegger, 1977), а также у более просто устроенной Quinqueloculina sp. свидетельствует о том, что в эволюции этой группы тоже возник ядерный дуализм.
У низших однокамерных лягинан и астроризан, так же как и у своеобразной группы спириллинат, ядерный дуализм не обнаружен. Первые исследования жизненных циклов и ядер многокамерных агглютинированных трохаммин (низшие роталианы) (Salami, 1976; Angell, 1990; Pawlowski et al., 1995) показали, что ядра их агамонтов тоже не дифференцированы. Гомокариотность может использоваться как дополнительный таксономический признак этих таксонов. Ядерный аппарат нодозариат практически не исследован.
Ядерный дуализм — одна из самых характерных особенностей фораминифер. Кроме того, у них произошла полимеризация ядер. Например, число генеративных ядер может достигать от нескольких десятков до нескольких тысяч и даже десятков тысяч; у некоторых видов произошла полимеризация и соматических ядер (4—6 у Rosalina, Glabratella, Globigerinoides; 40—60 у Sorites), Для фораминифер известен и второй путь увеличения ядерного вещества — полиплоидия. Цитофотометрические исследования, показавшие возрастание плоидности в ядре в 20— 30 раз, проводились для Patellina corrugata, Rotaliel- la heterocariotica (Zech, 1964), Cibicides lobatulus (Воронова, Селиванова, 1976). Полигеномное ядро отмечено также для Psammophaga simplora (Arnold, 1984) и Saccammina alba (Goldstein, 1988). Механизмом создания полиплоидного ядра служит, вероятно, не доведенное до конца деление. Дифференцировку ядер и их последующую полимеризацию и полиплоидизацию можно рассматривать как важный шаг в эволюции ядерного аппарата, ведущий к интенсификации его функций и повышению метаболической активности.
Гетероморфизм ядер протистов встречается еще только у инфузорий, однако у них он имеет существенные отличия (см. раздел «Место фораминифер в системе протистов»).
Митозы фораминифер происходят по типу закрытого внутриядерного плевромитоза (Myers, 1935; Zech, 1964; Воронова, 19786; Райков, 1978), но могут иметь и некоторые черты ортомитоза (Cesana, 1978). Во время гаплоидных митозов у Cibicides lobatulus(Воронова, 1976; Воронова, Михалевич, 1985) и у других видов (Le Calvez, 1938; Schwab, 1969, 1973, 1976) отмечены центросомы ицентриоли. Интересно, что у жгутиковых дочерних клеток гамонтов Myxotheca arenilega центросомы с центриолями, а у безжгутиковых агамет — без них. Клеточные центры деления наиболее полно изучены у Iridia lucida (Cesana, 1978;). Центросомы с центриолями, как бы охваченные снизу плотной акроплазматической чашечкой, образуются снаружи от ядерной оболочки. В этом месте на ядерной оболочке появляются довольно крупные окна. Затем напротив центросом, внутри от ядерной оболочки, появляется слой плотной плазмы, который служит центром организации микротрубочек веретена (ЦОМТ), идущих к кинетохорам хромосом (полуверетена). На поздних стадиях митоза полуверетёна расходятся к противоположным полюсам ядра. Часть микротрубочек соединяет оба ЦОМТа между собой, образуя внутриядерное центральное (латеральное) веретено, лежащее параллельно ядерной оболочке. Мейоз фораминифер изучен наиболее подробно Вороновой (19786) у ядер агамонта Cibicides lobatulus. Ею установлена предмейотическая дупликация ДНК, двухступенчатый характер мейоза; на стадии диплотены наблюдались хиазмы. Хиазмы во время мейоза отмечены также у Patellina corrugata (Berthold, 1977). В общих чертах мейоз фораминифер протекает, как у большинства простейших и многоклеточных, но как у Cibicides lobatulus, так и у других видов, у которых исследовался мейоз Patellina corrugata, Iridia lucida), не выражена экваториальная пластинка и практически отсутствует выраженная метафаза.
Ядерный аппарат фораминифер претерпевает сильные изменения на протяжении их сложного жизненного цикла.
ЖИЗНЕННЫЕ ЦИКЛЫ
Среди разных групп эукариот, у которых имеется смена ядерных фаз, фораминиферы занимают сравнительно примитивное место. Их жизненные циклы относятся к гетерофазным, т. е. гапло- и диплофазы составляют примерно равные части цикла (антитетическая смена поколений) с некоторым превалированием гаплофазы. Между первым агамным поколением (Aj) и гамогонией (В) у некоторых видов могут «вклиниваться» повторные агамные поколения (А2, А3). Таким образом, схему чередования поколений изображают как А—В—А—В либо как Aj—А2—А3—В. Дополнительные агамные поколения известны у многих, низших однокамерных форм (например, у Allogromia) и у псевдодвухкамерной Spirillina vivipara. Грелль (Grell, 1979) не наблюдал подобного повторения у высших роталиат, однако аналогичное явление отмечено у Discorbis orbicularis и Discorinopsis agua- gui', у Ammonia tepida агамные поколения многократно повторялись, особенно в культуре (Goldstein, Mood- ley, 1993). В культуре же у некоторых видов (например, у Elphidium crispum, — Hofker, 1930) происходит полное выпадение стадии гамонта и наблюдается длительное агамное размножение. Повторные агамные поколения были отмечены также для милиолят (Cornuspira, Calcituba, Spiroloculina). Жизненные циклы с повторными агамными поколениями были названы апогамными (МсЕпегу, Lee, 1976).У одного из планктонных видов, напротив, наблюдалась только половая часть цикла (Be, 1982). Возможно, несмотря на интенсивное изучение этого вида, его агамонты пока просто не обнаружены.
Фораминиферы — почти единственная группа животных, произошедших от жгутиконосцев, которая сохранила в своей эволюции такое соотношение гапло- и диплофаз. Среди низших растений аналогичная форма жизненного цикла широко распространена. Описана она также у миксоспоридий (Успенская, 1982). Сохранение в длительной эволюции фораминифер гетерофазной смены поколений можно рассматривать как дополнительное свидетельство их происхождения от жгутиковых.
К настоящему-времени примерно у 100 видов фораминифер в той или иной степени изучены жизненные циклы, в том числе у 26 из них при помощи электронного микроскопа. Полные жизненные циклы установлены у 20 видов. Лишь для 6 из них были проведены электронно-микроскопические исследования ядер (Cibicides lobatulus, — Воронова, 1976, 19786; Allogromia laticollaris, — Schwab, 1971; McE- nery, Lee, 1976; Myxotheca arenilega, — Foeyn, 1936; Schwab, 1969; Ovammina opaca, — Dahlgren, 1964, 1967a; Saccammina alba, — Goldstein, 1988, Tro- chammina sp., — Pawlowski et al., 1995b).
Жизненный цикл фораминифер чаще всего годичный, а его стадии обычно — сезонны. Зимой, весной и летом, как правило, наблюдается бесполое размножение — агамогония, в результате чего из агамет образуются гаплоидные гамонты. Гамогония у большинства изученных фораминифер начинается осенью, с понижением температуры, но может встречаться и летом; длительность ее составляет 24—30 ч. Гамогония — половой процесс, при котором гамонт образует гаметы, которые затем сливаются и дают начало агамонту (или шизонту, или диплонту). При этом у некоторых видов (Patellina corrugata, многие высшие роталиаты) родительские гамонты объединяются попарно пупочными* Сторонами в сизигий, стенка ракойины между ними растворяется, и гаметы копулируют в замкнутом пространстве. Такой способ размножения называют гамонтогамным, или пластогамным (например, у Discorbis patelliformis, Rosalina leei, Glabratel- la sulcata, у разных видов Bolivinella). Связывающая материнские раковины мембрана в отличие от обычных раковинных мембран состоит из не содержащих сульфаты мукополисахаридов (Lipps, Erskian, 1969). Снаружи сизигий окружается плотной органической мембраной. У Patellina corrugata могут образовываться агрегаты из нескольких раковин. У ряда пластогамных видов в ходе эволюции возникла аутогамия — копуляция гамет, образующихся у одной особи (Rotaliella heterocariotica, R. roscoffensis). Процесс образования гамет изучен у гамонтогамных видов более полно, чем у гаметогамных, когда гаметы копулируют в воде (Schwab, 1969, 1973; Воронова, 1976, 1978а, 19786; Cesana, 1978; Arnold, 1982, 1984; Grell, 1988). Число гамет в этом случае достигает нескольких десятков тысяч и в десятки, а иногда и более раз превосходит их количество у пластогамных видов.38 У одного из гаметогамных видов (Myxotheca arenilega) также доказана аутогамия. У Hastigerina pelagica (Spindler et al., 1978) иногда после множественного деления и образования гамет остатки цитоплазмы родительских особей регенерируют, восстанавливают растворенные камеры и продолжают существование и даже рост. Такие же наблюдения имеются и для других видов (Spiroloculina hyalina, — Arnold, 1955; Bolivina doniezi, — Sliter, 1970). Bee это свидетельствует о высокой регенеративной способности фораминифер.
У многих низших форм с тектиновой раковиной (Lagynana) наряду с обычным жизненным циклом встречается еще и почкование, и цитотомия (множественное почкование — например у Allogromia), и простое деление надвое. Агамогонию можно считать следующим этапом бесполого размножения (множественное деление). В процессе эволюции произошли прогрессивные изменения и в половой части цикла — от изогамии (Glabratella patelliformis) к анизогамии {Rubratella), иногда с избирательной сексуальной активностью гамет. Так, у Rubratella intermedia гамонты разных, а не одинаковых размеров. Гаметы их тоже анизогамные: потомство от более мелких гамонтов имеет более мелкие гаметы с более мелкими ядрами. Сексуальная дифференциация изучена экспериментально у Metarotaliella parva (Weber, 1965). Молодые гамонты не могут спариваться друг с другом, а только с более взрослыми и зрелыми. Взрослые гамонты могут друг с другом спариваться, но их реактивность по отношению друг к другу стимулируется более молодыми гамонтами (Lee, 1990).
Рассмотрим жизненный цикл на примере наиболее полно изученного гаметогамного вида Cibicides lobatulus. Начнем с агамогонии. После слияния двухжгутиковых гамет образуется диплоидная зигота, вырастающая в молодой агамонт, ядро которого сразу приступает к диплоидным митозам. В результате первого деления образуется 2 ядра; одно из них становится соматическим, или вегетативным, — Ма. Оно увеличивается в размерах, обогащается кариолимфой, в нем появляются богатые РНК ядрышки (нуклеолы). Из второго ядра в результате последующих делений возникает сначала 2, а затем до нескольких десятков генеративных ядер — Ми. В процессе агамогонии Ма увеличивается в размерах и продвигается из камеры в камеру по направлению к центру, а Ми мигрируют от центра к периферии, к последним камерам, где и находятся до конца. На конечной стадии они проходят 1-е и 2-е редукционные деления (двухступенчатый мейоз), в результате которых образуются гаплоидные ядра.
Интересно отметить, что в результате асинхронности мейозов в клетке одновременно существуют и диплоидные и гаплоидные ядра. Возможно, это явление широко распространено у многоядерных простейших. В мейозе участвуют только Ми. Хотя в некоторых случаях в Ма можно наблюдать как бы попытки совершить мейоз, он не бывает доведен до конца. При этом Ма либо только увеличйвается в размерах, либо, как у Rotaliella roscoffensis и некоторых других видов (Grell, 1979), в нем происходит конденсация хромосом и образование внутриядерного веретена. Хромосомы остаются унивалентными. После разрушения ядерной оболочки они выходят в цитоплазму, становятся пикнотическими и исчезают.
После мейоза в Ми могут происходить еще повторные гаплоидные митозы, обеспечивающие огромное количество молоди у гаметогамных видов. К концу массовых делений микронуклеусов, обычно после повторных митозов, Ма дегенерирует — теряет отчетливые очертания, а затем распадается на отдельные фрагменты, которые растворяются в цитоплазме. Вокруг вновь образовавшихся гаплоидных Ми обособляется цитоплазма и формируется раковина — это агаметы, дающие начало гамонту — половому поколению, которое и вступает в процесс гамогонии: ядра взрослых гамонтов делятся (гаплоидные митозы) и дают начало гаметам.
Таков жизненный цикл этого вида, в общих чертах отражающий жизненные циклы других высших фораминифер. Он отличается от последних только тем, что на стадии гамогонии у него, так же как и на стадии агамогонии, образуется Ма (иногда на стадии формирования первой камеры агаметы, но чаще на стадии 4—5 камер). Во время серии последовательных гаплоидных митозов гамогонии у генеративных ядер Ма становится лентообразным, четковццным и продвигается к 5-й и 6-й камерам, увлеченный токами цитоплазмы, при этом части его могут отрываться. К концу митозов гамогонии он дегенерирует. Агамонты всех изученных видов роталиат, глобиге- ринат и милиолят многоядерные и гетерокариотные. Ядерный дуализм гамонтов наблюдался только у Cibicides lobatulus. Наличие его подтверждено цитофотометрически, и от ядерного дуализма агамонтов он отличается тем, что возникает на гаплоидной основе.
Ввиду чрезвычайной сложности исследования ядерных процессов у фораминифер и интерпретации полученных цитологических данных, выполненных на разных уровнях исследования, ряд ценных работ по цитологии и жизненным циклам фораминифер (особенно проведенных на световом уровне, но иногда даже и на электронно-микроскопическом) не дает полного представления о сущности происходящих ядерных процессов. Поэтому относительно некоторых видов мы не можем точно сказать, гетерокари- отны они или гомокариотны и на какой стадии жизненного цикла. Образование ядер будущих гамет у гамонта из единственного ядра в большинстве работ не прослежено, что объясняется значительными методическими трудностями: до гамогонии цитоплазма еще не очищена от включений и Ма, занимающий не более одной миллионной объема особи, трудно отличить от ядер инородных организмов (остатков пищи, комменсалов, симбионтов); в популяции могут встречаться особи с разрушенными Ми и амик- ронуклеарные; вообще в цитоплазме нередко отмечается то или иное количество дегенерировавших ядер разного происхождения; окраска метиловым зеленым пиронином и железным гематоксилином маскирует ядра.
При морфологическом сходстве агамонтов и гамонтов многоядерные особи могут быть приняты за агамонтов. Ми агамонтов ярче и легче идентифицируются. Лишь окраска по Фёльгену полной серии достаточно тонких срезов дает возможность выявить все ядра, а цитофотометрия позволяет подтвердить их принадлежность к тому или иному поколению. Но твердые включения в цитоплазме фораминифер затрудняют получение полной серии срезов, а цитофо- тойетрические исследования пока единичны, поэтому некоторые цитологические наблюдения могут в дальнейшем не подтвердиться, как не подтвердилась «хромидиальная» теория (Le Calvez, 1938).
Первоначально считалось, что генеративные ядра формируются из так называемых хромидиев, существующих наряду с главным ядром. При определенных способах приготовления ядерных срезов ядерный аппарат С. lobatulus предстает в виде сочетания Ма и «хромидия». Последний на самом деле содержит по крайней мере 3 компонента: микронуклеусы, остатки дегенерировавших ядер, остатки ядерного материала инородных организмов (Воронова, Михалевич, 1985). В толстых срезах эти компоненты накладываются друг на друга. В настоящее время можно утверждать, что в ряде случаев хромидиальная сеть представляет цитоплазматическую РНК (рибосомальная сеть). Плотные «хромидии», состоящие из ДНК, по-видимому, и есть генеративные ядра, так же как и «сферические тельца», описанные у Polistomella (=Elphi- dium) (Lister, 1895). Все вышеизложенное дает основание предполагать, что ядерный дуализм гамонтов фораминифер, обнаруженный у Cibicides lobatulus, на самом деле, возможно, распространен в этой группе простейших гораздо шире.
Исследование ядер и жизненных циклов не изученных пока в этом отношении представителей класса Nodosariata, обладающих своеобразными типами строения раковин и ультраструктурой ее стенки, является первоочередной задачей, поскольку существенно дополнит общую картину и, вероятно, сможет пролить свет на филогенетические связи этой группы.
Представители однокамерных Astrorhizata с органической или агглютинированной раковиной и своеобразной примитивной по строению группы Spirillinata относятся к гомокариотным фораминиферам. В их жизненном цикле обычен одноядерный гамонт, дающий ядра многочисленных гамет, и многоядерныи агамонт с однородными ядрами без дифференциации Ма и Ми. У Iridia lucida (Le Calvez, 1936, 1953; Cesana, 1972, 1975, 1978) агамонт остается одноядерным вплоть до начала образования агамет. У других агамонтов Lagynana и Astrorhizana одноядерный период в жизни агамонта хотя и короткое время, но все же существует в отличие от изученных роталиат, где практически одноядерна лишь зигота (Воронова, Михалевич, 1985). Гольдштейн (Goldstein, 1988) отмечает, что из 40—70 ядер агамонта образуется лишь 3— 30 агамет, остальные ядра погибают. Гольдштейн осторожно называет их негенеративными; никаких других различий между ними и Ми она не обнаружила. По-видимому, здесь мы встречаемся с явлением, отмеченным и у других фораминифер (Allogromia lati- collaris, — Schwab, 1976; Patellina corrugata, — Berthold, 1971; Cibicides lobatulus, — Воронова, Михалевич, 1985; Михалевич, 1999), когда часть ядерного и цитоплазматического материала погибает и не используется непосредственно при развитии потомства. У планктонной Hastigerina pelagica эти остатки содержали вакуоли, несколько ядер и жгутики и образовывали сферические тельца, способные двигаться (Spindler et al., 1978).
Арнольд (Arnold, 1984) подробно исследовал своеобразие формирования Ми у гамонта Psammophaga simplora. Сравнение этой стадии жизненного цикла данного вида с аналогичной фазой гетерокариотного гамонта Cibicides lobatulus, а также с гетерокариотными агамонтами других видов показывает, что гамогонию Psammophaga simplora все же нельзя отнести к гетерокариотному типу, поскольку (как и указывает автор) Ми, образующиеся в первичном ядре, последовательно сменяют его, а не существуют одновременно. Большую часть жизни у гамонта Р. simplora имеется 1 ядро. После выхода генеративных ядер из-под оболочки первичного ядра в последнем практически не остается хроматинового материала и оно существует еще некоторое время не как полноценное ядро, а как его остаток. Здесь мы опять сталкиваемся с неполным использованием ядерного вещества при формировании потомства — как бы с потерей части его. При истинной гетерокариотности на протяжении основной части существования агамонта (у Cibicides lobatulus и гамонта) Ма и Ми сосуществуют одновременно.
Исследования Арнольда еще раз показали сложность и многообразие ядерных изменений в процессе жизненного цикла фораминифер и необходимость дополнительных исследований. И все же анализ имеющихся на сегодняшний день сведений по жизненным циклам примитивных однокамерных фораминифер не позволил пока обнаружить у них гетерокариот- ность; была четко установлена лишь многоядерность агамонтов. Исключение среди Lagynana представляет Phthanotrochus arcanus (Arnold, 1978), у которого с некоторой долей сомнения автор называет более крупные дегенерирующие ядра (8—14 мкм) Ма. Они существуют одновременно с множеством более мелких (1.6—2.4 мкм) Ми.
Ph. arcanus в отличие от остальных Lagynana имеет хотя и органическую, но многокамерную тро- хоидную раковину роталоидного типа. Если ядерный дуализм у данного вида действительно существует, то это подтверждает его родство с другими морфологически сходными известковыми секреционными раковинами роталиат и проливает свет на происхождение последних.
Систематическое положение Ph. arcanus в этом случае должно быть изменено (ближе к низшим представителям роталиат с агглютинированной раковиной — к подклассу Textulariana). Предположение Арнольда (Arnold, 1979) о происхождении высших секреционных форм от многокамерных органических раковин сходного строения, развиваемое им на примере Periptigma и Miliolata, получит в этом случае еще одно подтверждение в параллельной группе фораминифер. Обзор всех известных в настоящее время данных по жизненным циклам фораминифер позволяет разбить их на 3 группы (Воронова, Михалевич, 1985; Михалевич, 1999). 1. С гомокариотными многоядерными агамонтами и одноядерными гамонтами (Lagynana, Astrorhizana, Spirillinata); исключение составляет Iridia lucida с одноядерным агамонтом.
2. С гетерокариотными агамонтами и одноядерными гамонтами (Miliolata, большинство известных Ro- taliata, Globigerinata).
3. С ядерным дуализмом как агамонтов, так и гамонтов (некоторые Rotaliata: Cibicides lobatulus; возможно, Elphidium).
Ясно, что первый из них является исходным типом, что подтверждается работами Грелля и его школы (Weber, 1965; Grelle, Bardele, 1977; Grell, 1979, 1988), в которых прослежены разные этапы дифференцировки соматических ядер: от более примитивных, когда Ма во время мейоза не только увеличивается в размерах, но в нем происходит конденсация хромосом (хотя и остающихся унивалентными) и даже формируется веретено (Rotaliella roscoffen- sis), как бы не до конца повторяя процессы, происходящие в микронуклеусах, до простого увеличения в размерах с увеличением количества ДНК (7?. hete- rocariotica). Дифференциация ядер у Cibicides lobatulus зашла достаточно далеко (Воронова, Михалевич, 1985; Михалевич, 1999). Вероятно, именно кратное увеличение ДНК Ма, происходящее параллельно с его увеличением в микронуклеусах, при не доведенном до конца процессе деления в первых в отличие от вторых и объясняет механизм создания полиплоидного ядра.
В гаметогенезе разных групп фораминифер имеются свои особенности. Ряд видов, приступая к размножению, формирует цисты из слабо сцементированного постороннего материала (Cibicides lobatulus, Rosalina globularis) — такие же как у Rosalina flori- dana при построении новых камер. У агглютинированной однокамерной Cribrothalamina alba в стенке раковины образуются 10—15 крупных отверстий — «пор», дающих выход гаметам (Goldstein, Barker, 1988). У донных роталиат гаметы могут выходить как через расширенные резорбцией поры (Cibicides lobatulus), так и через устье (Ammonia tepida), у планктонных форм — только через широкие устья. Пелагические формы имеют еще ряд особенностей. Выход гамет у них может быть связан с лунными циклами (например, у Hastigerina pelagica, — Spindler, 1979).
При гаметогенезе происходят большие изменения и в скелете, — в результате вторичной гаметогенетической кальцификации ячеистая у многих планктонных фораминифер ультраструктура поверхности сглаживается, стенка становится толще, поры забиваются известью почти полностью, раковина сбрасывает подвижно сочлененные с нею иглы и погружается на дно (Be et al., 1976; Be, 1980). Есть виды, которые образуют последнюю репродуктивную камеру особой формы (Globigerinoides sacculifer). Нечто подобное можно встретить и у донных форм (Sorites orbicularis, — Kloss, 1980). Среди донных имеются виды с кратковременной пелагической стадией в их жизненном цикле. Наиболее яркий пример — плавучие гамонты Tretomphalus и Cymba- loporetta с шарообразной камерой внизу раковины. Их агамонтов без такой камеры относили к роду Rosalina. В период гаметообразования гамонт Tretomphalus bulloides инцистируется. Перед самым выходом гамет он формирует большую флотирующую, наполненную газом камеру снизу трохоидной раковины, освобождается из цисты и всплывает к поверхности воды. Там двухжгутиковые гаметы покидают материнскую раковину и копулируют в воде. Зигота снова опускается на дно. На этом пелагическая часть цикла заканчивается. Пелагические стадии донных форм способствуют более широкому их расселению (Михалевич, 1983; Воронова, Михалевич, 1985).
Наличие 2 ядерных фаз в жизненном цикле фораминифер проявляется не только в цитологических особенностях, но также и в строении скелета. Как и у других организмов с подобной сменой поколений, она может быть изоморфной и гетероморфной, так как обе формы эволюируют в значительной степени автономно. Агамонты большинства фораминифер имеют микросферическую, гамонты— мегалосфери- ческую раковину (у спириллинат соотношение обратное). В простейшем случае они отличаются лишь размерами начальной камеры — пролокулуса (что и отражено в их названии) и общими размерами: мик- росферические агамонты крупнее макросферических гамонтов. Примером могут служить Cibicides lobatulus, Rotaliella heterocariotica, Ammonia beccarii, Ja- dammina zernovi. Если агамное поколение повторяется дважды, появляются микросфери- ческие агамонты (А1) и макросферические агамонты (А2) (например, y Elphidium crispum, Heterostegina depressa). У ряда высокоорганизованных групп фораминифер с очень большим числом камер (например, у некоторых Nummulitacea подкласса Rotaliana — Biplanispira) 2 начальные камеры мегалосфе- рического гамонта (пролокулус и дейтероконх) очень крупные, иногда крупнее остальных. Обе они окружены общей неперфорированной стенкой, отличающейся от стенки остальной раковины, имеют 1 центральную крупную округлую пору и ряды пор в основании септы. Их называют зародышевыми камерами, или эмбрионами.
Как у агглютинирующих, так и у секретирующих видов наблюдается и более резкое проявление гетероморфизма (Воронова, Михалевич, 1985; Михалевич, 1999;). Раковины разных генераций могут отличаться друг от друга очертаниями, общими пропорциями, соотношением разных отделов, наличием какого-нибудь отдела лишь у одной из них. Например, часто у выпрямленных форм в разных таксонах начальный плоскоспиральный трохоидный или клубковидный отдел имеется у агамонтов, но отсутствует у гамонтов. При этом бесполое поколение с микросферической раковиной часто повторяет более примитивные предковые черты. Таким образом, по онтогенезу раковин можно судить о предшествующих этапах филогенетического развития группы.
СТРОЕНИЕ ГАМЕТ
Гаметы подавляющего большинства форамини- фер двухжгугиковые, с жгутиками различной длины, содержат ядро, жировые капли, митохондрии, осмиофильные гранулы, микротельца, диктиосомы аппарата Гольджи; у видов с избирательной сексуальной активностью — акросому (Cesana, 1972).У Glabratella и Nummulites venosus гаметы трех- жгугиковые. Гаметы с таким числом жгутиков не встречаются у саркодовых и вообще чрезвычайно редки у простейших (у некоторых Sporozoa). У амебоидных гамет {Patellina corrugata, Spirillina vivipara, Metarotaliella simplex, ряда Rotaliella) отсутствие жгутика вторично. Он утрачен, так как в нем нет необходимости при гамонтогамном способе размножения. Гаметы некоторых милиолид имеют образование, внешне сходное с гаптонемой, — прямой, торчащий вперёд аксостиль; ультраструктура его до сих пор не исследована. Жгутики же фораминифер имеют на поперечном срезе обычное для всех жгутиков строение (2 центральные и 9 пар периферических фибрилл). У Boderia turneri (Hedley et al., 1968) и Operculina cf. complanata (Roettger et al., 1998) один из жгутиков имеет поверхностные волоски — мастигонемы.
Основные направления эволюции
Несмотря на многочисленные классические исследования (Догель, 1929; Полянский, 1970; Полянский, Райков, 1977), морфологические закономерности эволюцйи на уровне одноклеточных разработаны далеко не так основательно, как у многоклеточных. Скелет фораминифер отражает основной план строения одноклеточного организма; в процессе эволюции группы он подвергся наиболее сильным изменениям. Принципиальное значение для понимания эволюции группы и построения ее системы имеет вопрос о том, какие признаки считать первичными, какие — возникшими параллельно и независимо в разных группах, а какие — конвергентно; при этом мы исходим из положений Шмальгаузена (1969). Изменения скелета фораминифер происходили в 2 главных направлениях — формы раковины и ее стенки. Это — два взаимосвязанных процесса. Для удобства изложения рассмотрим каждый из них в отдельности.Одна из основных особенностей эволюции скелета фораминифер — возникновение многокамерности, отражающей периодический, неравномерный характер роста. Первые проявления этой тенденции встречаются даже у раковин с органической стенкой. В каждой из основных линий развития этот процесс получил дальнейшее развитие. Его можно рассматривать как процесс полимеризации, столь распространенный у одноклеточных. В эволюционном плане многокамерность фораминифер можно сравнить с возникновением многоклеточности, когда повышение сложности организма идет за счет полимеризации внутриклеточных компонентов, а не за счет полимеризации клеток (Михалевич, 1999).
Из 4 типов полимеризации (Подлипаев и др., 1974) у фораминифер мы наблюдали 2:
1) фиссацию (разделение первоначально имевшихся образований, — например, у Calligella, Рагаthikinella, Ammoscalarid)
2) дополнительную полимеризацию (добавление новых гомологичных единиц, — как типичные примеры — реофаксы, квинквелокулины, нодозарии, но- нионы, дискорбисы). Подавляющее большинство фораминифер пошли по второму пути; первый характерен для примитивных групп (подклассы Laginana, Astror- hizana и Ammodiscana). Возникновение многокамерное™ по способу фиссации при непрерывном росте (в отличие от прерывистого, достроечного роста) мы называем ложной многокамерностью (псевдомного- камерностью); сочленение камер в обоих случаях различное (Михалевич, 1981) и может рассматриваться как признак высокого таксономического ранга. Возможно сочетание двух способов (многоэтажная полимеризация): подразделение на камерки внутри сформированных камер в группах средней сложности организации (Spirocyclinidae из литуолид, Phenacophragma из эндотирид, своеобразные группы Carterina, Patellina) и у наиболее высокоразвитых многокамерных форм в линиях с различным типом стенки — орбитолин (Textulariana), фузулинид (Ammodiscana), милиолят (вертикальные и тангенциальные септы альвеолинид), высших роталиат (Heterostegina, Cycloclypeus), где этот способ дополнительный, но не ведущий. Переход от камер, одинаковых по форме и размерам (Saccamminopsis, Hormosinella, Grigelis; последний род выделен на основании способа сочленения камер и их равной величины, — Михалевич, 1981), к неодинаковым, как это имеет место у большинства видов, — следующий этап дифференциации на базе предшествующей полимеризации. Его конечный результат — уменьшение числа камер в последних оборотах, вплоть до 1, также проходил параллельно в разных группах (Ammospha- erulina из Литуолид, Periloculina из милиолят, Lagenoglandulina из нодозариат, Orbulina из глобигери- нат). Такого рода дифференциация ведет к уменьшению автономности камер, подчинению их целому организму, усложнению организменной структуры. У высших многокамерных текстуляриан (орбитолина) и роталиан (нуммулитес, бипланиспира, гетеросте- гина), где число камер особенно велико, происходит дальнейшая глубокая дифференциация камер, когда начальные зародышевые и следующие за ними медианные, экваториальные и периферические слои камер имеют различное строение.
Широко распространено мнение, что многокамерные формы произошли от двухкамерных со второй трубчатой камерой, например литуолиды от аммодис- цид. Мы считаем, что хотя такой путь развития действительно имел место, он представляет собой лишь второстепенный, побочный путь (Михалевич, 1999). Подобные формы возникали параллельно в разных филогенетических ветвях. Они характеризуются рядом примитивных черт, особым сочленением камер, сохранением трубчатой камеры на ранних стадиях развития (Toumayellidae, Lituotubidae, Patellinidae; многие Miliolidae). У большинства многокамерных форм (нодозариаты, роталиаты) последующие камеры нарастают сразу же вслед за округлым пролокулусом.
Анализ встречаемости разных типов раковин в крупных таксонах (классах, подклассах, — Михалевич, 1981, 1999) показал, что, несмотря на параллельное возникновение морфологических типов во многих таксонах, их распределение и богатство неодинаковы в каждой ветви. Наименьшее их число — у примитивных тектиновых и агглютинированных форм (Astrorhizata — в основном однокамерные), своеобразной боковой ветви сек- реционных форм (Spirillinata), специализированных планктонных форм (Globigerinata), наибольшее — в подклассах Textulariana и Rotaliana, где почти каждому морфологическому типу агглютинированных и микрогранулярных раковин соответствует изоморфный аналог с бифонтинальной стенкой. В этих же таксонах получил наибольшее развитие в отличие от спирально-плоскостных асимметричный трохоидный тип раковин, обеспечивающий кратчайшее расстояние между начальными и последними камерами и создающий наибольшие филогенетические возможности, особенно в случае возникновения дополнительных отверстий в пупочной области, которые связывают цитоплазму с внешней средой. Трохо- идные раковины встречаются и в классе спирилли- ната. Однорядные раковины у роталиан — исключение (Stilostomella), они, скорее всего, являются вторично-однорядными. Во всяком случае, по строению устья и зуба эти животные хорошо отличаются от однорядных нодозариат с радиальным или простым устьем. Кроме обилия и разнообразия однорядных форм у нодозариат встречаются особые полиморфиноидный и плектофрондикуляриевый типы с шевронообразно изогнутыми камерами. Из спирально свернутых раковин у нодозариат представлен только плоскоспиральный тип. Последний легко отличить от плоскоспиральных роталиат по строению и положению устья (у них оно конечное, а не в основании устьевой поверхности).
Примитивные однокамерные раковины встречаются лишь в низших таксонах и у низших представителей милиолят и нодозариат (мы не считаем ляген вторично однокамерными). У милиолят преобладают клубковидные типы, не представленные у высших роталиат, трохоидный тип для милиолят — исключение. (В связи с этим мы изменили место Fisherinidae в системе — перевели их из Cornuspiracea в Peneroplidea). Исследование ультраструктуры стенки фишеринид (Михалевич, 1988) подтвердило их принадлежность к милиолятам.
У прикрепленных видов самых разных таксонов (вплоть до высших) раковины приобретают неправильную форму конвергентно (Haddonia, Manorella из Placopsilinidae, Textulariana; Cornuspiramia, Nube- culinopsis из Miliolata; Bullopora из Nodosarioida, No- dosariana; Cibicidella, Vagocibicides, Miniacina из Ro- taliata). Большое число параллелизмов дает развитие устья и его структур в разных группах — от единичного устья к множественному и ситовидному, от простых внешних и внутренних зубов до сложных внутренних пластинок и трубок (Михалевич, 1981, 1999). В развитии устья также четко прослеживаются процессы полимеризации и дальнейшей олигомеризации. Множественное устье с нефиксированным положением в виде не имеющих четкой формы отверстий у многих астроризат мы считаем первично-множественным, а появление у них одного фиксированного, морфологически оформленного устья более крупного размера рассматривается как прогрессивный процесс олигомеризации (Михалевич, 1995). Появление нескольких отверстий на устьевой поверхности вместо одного у высших многокамерных форм — новая ступень полимеризации. В этом случае возникает вторично-множественное устье.
Примеры постепенного усложнения устья в этом направлении можно найти почти во всех крупных таксонах. Особенно много их среди Textulariana (почти в каждом семействе литуолид, текстуляриид, трохамминид, атаксофрагмиид можно составить такие параллельные ряды), у многих Rotaliana и Miliolana, некоторых псевдомногокамерных и многокамерных Spirillinata (торнайеллиды, эндотириды, фузу- линиды). У Nodosariana множественное устье образуется очень редко (Cribrorobulina), что можно связать с преобладанием у них лучистого устья — достаточно большого и уже подразделенного радиальными ребрами. Интересно отметить, что среди Rotaliana множественное и ситовидное устье встречаются, как правило, у более примитивных форм, не имеющих системы каналов (Cribrogloborotalia, Poroeponides). При наличии этой системы устьевые отверстия иногда совсем исчезают (некоторые эльфидииды).
Процесс образования связанных с устьем желобков и трубок привел к частичному или полному обособлению цитоплазмы и ее дальнейшей глубокой дифференциации. У роталиат можно проследить развитие внутренних скелетных образований устья — от коротких пластинок и язычков (Turrilinoidea, Episto- minoides, Ammonia, Eponidella, Globorotalites) до желобообразных пластинок (Siphogerinoides, Eouvigeri- na, Orthokarstenia) и трубок и сложных зубных пластинок (Bolivina, Brizalina, Uvigerina и особенно Bulimina, Stainforthia), все более удлиняющихся и образующих, как и у Osangularia и Colettes, сплошную систему, которая соединяет все камеры. Эта система взаимосвязанных внутренних устьевых элементов функционально сходна с системой каналов, но не гомологична им. Устьевые трубки роталиат и нодозариат (эллипсолагены, полиморфиниды) различаются по строению и могут рассматриваться как конвергентные. Устьевой зуб также возникает параллельно и независимо в нескольких группах. У Schlumbergerinana он представлен примитивным, часто плохо заметным образованием. Наибольшее развитие устьевой зуб получил у Milioloida, где у родов Cribrolinoides, Tortoriello, Flintina (Михалевич, 1976, 1999;) он достигает такой сложности, что может быть назван зубной пластинкой (иного происхождения, чем у Bulimina (Rotaliata)). Устьевые зубы милиолид нередко множественны (Dentostomina, некоторые Spiroloculina, — полимеризация), могут быть неодинаковых размеров и формы (Dentostomina — дифференциация); изредка они сливаются в единое образование (Tortonella, Cribrolinoides — дальнейшая олигомеризация). Морфологическое богатство скелетных структур устья связано с их большой и разнообразной функциональной нагрузкой. Дополнительные шовные устья часты у низших и особенно у высших Rotaliata; особенно большое развитие они получили у планктонных форм; встречаются у некоторых спириллинат, у милиолят — лишь в виде исключения; у Nodosariata не развиты (кроме Delosina). Появление дополнительных устьев — важный прогрессивный признак в развитии группы, которому ранее не уделялось должного внимания.
В эволюции протистов значительную роль играет прогрессивное увеличение размеров тела. Однако самые крупные особи — гиганты в мире протистов (от 1 до 18 см) встречаются среди примитивных однокамерных и двухкамерных форм. У многокамерных форм рост сдерживается разобщенностью камер. Системы, достигшие высокой степени полимеризации и дифференциации, для обеспечения существования организма нуждаются в интеграции отдельных частей. Интегрирующие системы (столоны, внутренние устьевые системы, туннели, каналы) фораминифер описаны выше (см. раздел «Интегрирующие системы»), они возникают конвергентно в разных ветвях в наиболее продвинутых группах и обеспечивают связь начальных камер с поздними. Зачатки примитивной системы каналов имеются у палеозойских лазиодисцид, инволютинид (у вымерших в мелу Hottin- gerellida), у юрских спириллинид (Spirotrocholina, — Азбель, 1986). Характерно, что у всех этих форм она возникла лишь при трохо- идном типе раковин, создающем, как отмечалось выше, дополнительные структурные возможности.
Каналы отличаются от столонов и туннелей морфологией, происхождением и функцией. Самая совершенная система каналов имеется у высших роталиат. Совокупность каналов представляет собой уникальную систему организменного уровня, сравнимую по функции с кровеносной системой высших многоклеточных, но функционирующую в одной клетке.
Большинство групп с развитой системой туннелей вымерло (фузулиниды из класса спириллината — в перми; орбитолины из подкласса текстуляриана — в эоцене). Alveolinina (милиоляна) приобрели систему туннелей в мелу, некоторые формы сохранились в тропиках до сих пор. Среди спириллинат, развивших примитивную систему каналов (Михалевич, 1936, 1999), дожили до настоящего времени лишь формы без каналов (спириллиниды, пателли- ниды, аннулопателлиниды). Rotaliida и Nummulitida с каналами существуют с мела по настоящее время, некоторые из них (Elphidiidae) сумели приспособиться к жизни в холодных водах.
Часть фораминифер пошла по иному пути в устранении противоречия между многокамерностью и единством всего организма: у взрослых особей происходит резорбция стенок предшествующих камер и как бы возврат к однокамерному состоянию (Pegidii- dae — Rotalioida, Ellipsolingulina, Lagenoglandulina, Bombulina — Nodosarioida, Orbulina — Globigerinidae). Этот путь имеет меньшее прогрессивное значение и не получил широкого развития.
Стенка раковин фораминифер менялась от органической до агглютинированной и затем до секреционной. Наибольшие изменения произошли в развитии секреционных раковин (Михалевич, 1999). Радиальная стенка нодозариат и стенка спириллинат отличаются от микрогранулярной большей упорядоченностью укладки кристаллов и органических прослоев. Возникновение бифонтинальной стенки можно считать изменением типа ароморфоза. Она отличается наиболее высокой степенью упорядоченности всех ее элементов: строго ориентированной укладкой кристаллов, четкой разграниченностью органических и известковых слоев, не только четкой разметкой пространства порами, но и возникновением поровых канальцев со сложной внутренней структурой. Эти особенности связаны с более равномерным, густым и упорядоченным расположением центров секреции. Их пространственная организация определяется, по-видимому, аппаратом Гольджи. При упорядоченной укладке правильных кристаллов стенка достигает наибольшей прочности при наименьшей ее толщине. У представителей с агглютинированной и микрогранулярной стенкой развиты внутренние ее утолщения — отмеченные раньше альвеолярные, губчатые слои, которые изредка встречаются у астроризат (Daitrona, Masonella) и получили особое развитие у разных отрядов текстуляриан, а также у фузулинид. Отложения внутренних скелетных образований (столбики орбитолин, бьековинид — текстуляриана, меандропсинид — милиоляна, хоматы фузулинид, особенно развиты при микрогранулярной и фарфоровидной стенке. Наиболее полное развитие они получили у Fusulinoida. Эти структурные особенности характеризуют надсемейства и отряды. Некоторое конвергентное сходство прослеживается и в строении псевдопор в микрогранулярной стенке, и в единичных случаях их возникновения в фарфоровидной стенке (см. раздел «Строение пор»). И те и другие могут быть извилистыми, ветвистыми, оканчиваться слепо. Возможность внешних образований на наружной стенке возникла лишь при полностью секреционной стенке (ребра, шипы, иглы, ячеи, гранулы у милиолян, нодозариан, спириллинан, роталиан, глобигеринат. Детали их строения могут служить родовыми и видовыми признаками. Дополнительные скелетные пластинки, прикрывающие пупок или швы, получили широкое развитие лишь у роталиат и глобигеринат. Наиболее развиты они у высших роталиат в подклассе Rotaliana и у Globigerinata, но в некоторых случаях известны и в низшем подклассе этого класса, у Textulariana (Asterotrochammina, Dobrogelina, Arenagula. У спириллинат, высших милиолят и нодозариат дополнительные скелетные пластинки не возникли. Их наличие можно рассматривать как признак групп высокого таксономического ранга, их форма и положение характеризуют более низкие таксоны.
Рассмотренные типы секреционной известковой стенки сложились в процессе эволюционного развития фораминифер и характеризуют определенные филогенетические линии развития (в приведенной ниже системе — классы; см. также: Михалевич, 1999). У высших представителей этих классов (их высших подклассов — Spirillinana, Miliolana, Nodosariana, Rotaliana) возник свой особый тип ультраструктуры стенки. Разные типы укладки кристаллов в известковой стенке у милиойян, спирилинан, нодозариан, роталиан — пример дивергенции, но лучистое расположение столбиков кристаллов, перпендикулярных поверхности раковины, в монофонтинальной стенке спириллинан и нодозариан и в бифонтинальной стенке роталиан возникло параллельно. Тенденция к смене агглютинированной стенки секреционной известковой при одном и том же типе строения раковин, как показали морфологические и экспериментальные данные (Михалевич, 1992, 1995, 1998, 1999; см. также раздел «Секреционная известковая стенка») и анализ их геологической истории, также возникала параллельно в каждой линии.
Проведенный выше анализ ультраструктуры стенки современных форм заставляет нас по-новому взглянуть на сборную группу палеозойских Fusulinacea. В ее состав входят формы с различными типами раковины и стенки. Количество параллелизмов, и так достаточно большое среди фораминифер, еще увеличивается существованием параллельной системы фузулинацей.
Сравнение слоев наиболее сложной стенки фузулинид с таковой высших текстуляриан (орбитолина) показывает их большое сходство (Михалевич, 1999) наружный, органический слой соответствует тектуму, срединный, микрогранулярный — кериотеке; ампулообразные альвеолы подобны таковым неошвагерин. Микрогранулярная стенка фузулинид, возможно, отличалась большей упорядоченностью зерен (Т. Н. Исакова, устн. сообщ.), что объясняет появление волокнистости при диагенезе. Фиброзный волокнистый слой возникает при диагенезе и радиальной и микрогранулярной стенки (Hohenegger, Piller, 1975). Отсутствие принципиальных различий в строении стенки текстуляриан и палеозойских фузулиноид показывает, что ее строение не может служить надежным диагностическим признаком для этих таксонов. Поэтому при ревизии сборной группы прежних фузулинацей (в понимании Лёблика и Таппан, — Loeblich, Tappan, 1988) мы опирались главным образом на морфологические признаки раковин и устья, особенно на начальных стадиях развития. Низшие фузулинацеи, в понимании Лёблика и Таппан (Loeblich, Tappan, 1988), попадают в предлагаемой нами системе в различные классы (см. раздел «Систематический обзор») в зависимости от формы раковины, а также появления лучистого слоя стенки.
Некоторые особенности ядер и их изменения в процессе жизненного цикла в таксонах разной степени продвинутости были отмечены ранее ;(см. разделы «Ядро», «Жизненные циклы»; см. также: Михалевич, 1999). У низших лягинан наряду с обычным жизненным циклом встречается простое деление надвое. Агамогонию можно считать следующим этапом бесполого размножения (множественное деление). В процессе эволюции произошли прогрессивные изменения и в половой части цикла — от изогамии (Glabratella patelliformis) к анизогамии (Rubratella), иногда с сексуальной активностью гамет. Как показал анализ современных данных по цитологии и жизненным циклам, направленность основных эволюционных изменений этих структур и циклов у фораминифер идет параллельно тенденциям прогрессивного развития их скелетов (Михалевич, 1980, 1981, 1999). Гетерокари- отность возникла в наиболее эволюционно продвинутых группах (см. разделы «Ядро», «Жизненные циклы») — у глобигеринат, высших милиолят и высших роталиат. У низших роталиат (текстуляриан) агамонты гомокариотны. Во всяком случае, Павловскому с соавт. (Pawlowski et al., 1995b) не удалось обнаружить у агамонта трохаммины ядерного дуализма. Скорее всего, такими же окажутся и агамонты низших милиолят (шлумбергеринаны). Не исключено, что такая же картина будет обнаружена у высших и низших нодозариат, данные по которым пока отсутствуют, так как ранее их включали в роталиат и не проявляли к ним специального интереса. У более примитивных спириллинат, у которых агамонты даже высших представителей гомокариотны, тем более трудно ожидать обнаружения диморфизма у низших форм (аммодискан). Таким образом, определенный систематический подход помогает наметить на будущее стратегию исследования ядерного аппарата.
Нельзя не отметить и такое своеобразное направление развития фораминифер, как их совместная эволюция с симбионтами. У многих секреционных фораминифер (в продвинутых группах роталиат — Amphis- tegina, Calcarina, Nummulites и милиолят — Alveolina, Sorites) сложились с симбионтами длительные отношения (Amphistegina даже стала симбионтзависимой). Это повлияло на размеры и форму раковин, их внутреннюю морфологию (усложнение, появление большого числа камер и камерок), строение стенки (частичная резорбция органического вещества, появление более тонких, прозрачных участков, обеспечивающих доступ света к симбионтам). Вся система симбионт— хозяин получает дополнительную энергию. У исследованных видов такие взаимоотношения резко увеличивают скорость кальцинации и, вероятно, производство органических мембран и ведут к увеличению общих размеров особей. В различных филогенетических линиях развития фораминифер формы, эволюировав- шие совместно с симбионтами, достигли наибольшей сложности организации.
Как видно из вышеизложенного, фораминиферы дают поразительное число примеров параллелизма в строении раковины и устья, что можно объяснить их широким современным и геологическим распространением, разнообразными условиями существования, огромным многообразием форм. Можно сказать, что они используют почти все варианты комбинаций из заданного природой набора признаков, составляющих универсальное пространство возможностей. Зная сочетание различных черт строения у фораминифер и тенденции их развития, можно предсказать нахождение определенных форм (например, различные типы строения устья милиолид — наличие устьевой лопасти, простого или сложного зуба, множественного устья при различных способах навивания — квинквелокулиновое, трилокулиновое, билокулино- вое, сигмоилиновое; см. также: Михалевич, 1999). Так, долгое время у сигмоилиновых раковин не были описаны формы с множественным устьем, у спиролокулиновых — со сложным зубом; позднее они были найдены (Longiapertina Seiglie, 1979; Bidentina Mikhalevich, 1988). Таким образом, современная система форминифер, несмотря на многие еще нерешенные вопросы, обладает и прогностической ценностью.
Наибольшее число параллелизмов в пределах всего подтипа фораминифер охватывает первые ступени их усложнения (Михалевич, 1981, 1999): возникновение многокамерное™, способы образования камер, наиболее простые случаи усложнения устья и появления дополнительных устьев. Эти тенденции развиваются до тех пор, пока дивергенция не исчерпывает всех возможностей старых структур (столоны и туннели сменяются каналами, агглютинированная стенка — известковой). Как мы видели выше, агглютинированный тип стенки обладает ограниченными структурными возможностями. При известковой секреционной стенке значительное число запретов, по- видимому, оказывается снятым. Все это дает нам основание относить возникновение известкового сек- реционного скелета, особенно бифонтинальной стенки, к новообразованиям типа ароморфозов, существенно изменяющих план строения организма, его основные свойства.
Проведенный анализ показал, что изменения устьев, интегрирующих систем и типов стенки происходили параллельно у раковин разного типа строения, но в каждой из рассмотренных филогенетических ветвей тенденции развития реализованы в неодинаковой степени, достигают разного уровня совершенства и имеют своеобразные черты. Поэтому при рассмотрении классов, мы берем за основу план строения раковин, способ навивания, тип симметрии, а также учитываем комплекс признаков других структур и ультраструктуру стенки (последняя характеризует подклассы, иногда отряды).
Качественное своеобразие эволюции наиболее бедно в примитивных подклассах Lagynana и Astrorhizana. Они обладают преимущественно однокамерными, часто неправильными раковинами, простым устьем и, как правило, простой стенкой, органической или агглютинированной, реже микрогранулярной. Их агамонты долго сохраняют 1 ядро; разделение ядер на соматические и генеративные у них отсутствует; нет четкой дифференциации на экто- и эндоплазму. Можно предположить, что после цитологических исследований многие из них окажутся принадлежащими к другим типам протистов, как это произошло с Pelosina, — после проведенного исследования мы относим ее к ксенофиофориям (Михалевич, Воронова, 1999).
Гомокариотность характерна и для своеобразной древней примитивной ветви — современных спириллинат, обладающих двухкамерной раковиной с длинной второй трубчатой камерой (или произошедших от них), с простым устьем, но с упорядоченной структурой секреционной стенки у их высших форм. Их древние формы сочетают ряд плезиоморфных черт (наличие трубчатой камеры у многих из них хотя бы на ранней стадии, псевдокамерность, примитивные септы, простое устье, клубковидное навивание) с апоморфными (наличие туннелей и каналов, дополнительных устьев, трохоидной формы раковин).
У милиолят и нодозариат типы строения раковин довольно многообразны (у первых преобладают неправильно- и правильно-клубковидные, у вторых — одноосные, спирально-винтовые и инволютные плоскоспиральные, отличающиеся от плоскоспиральных раковин роталиат конечным положением устья). Каждый из этих классов обладает особыми типами усложнения устьев (у милиолят — с зубами, у нодозариат — радиальные либо с трубкой), в обоих классах не развиты дополнительные устья, дополнительные скелетные пластинки. Интегрирующие системы первых представлены столонами и туннелями; у вторых эти системы почти не развиты. Стенка у высших подклассов обоих классов монофонтинальная, различной укладки. Ядерный диморфизм обнаружен у милиолят (по нодозариатам нет данных). Какое бы из рассмотренных выше эволюционных направлений мы не взяли — строение ядер, жизненные циклы с ядерным дуализмом, типы строения раковин (наиболее многообразны, с преобладанием плоскоспиральных и особенно трохоидных), устья (сложные зубные пластинки, клапаны и трубки, дополнительные устья), дополнительные наружные скелетные пластинки, взаимосвязанные внутренние устьевые системы, сложные интегрирующие системы каналов — все они наиболее разнообразно и сложно представлены у высших роталиат. Появление бифонтинальной стенки, обладающей структурой, которая обеспечивает легкость и прочность раковин при наименьшей толщине, сделало для роталиат возможными ароморфные преобразования, резкое возрастание темпов эволюции, увеличение числа высших и низших таксонов, адаптивную радиацию, появление планктонных форм. Происхождение последних от донных роталиан типа дискорбисов или нонионов доказывается морфологическим сходством и наличием донной стадии в их жизненном цикле. Арнольд (Агnold, 1978) предполагает, что милиоляты произошли от предковых форм, подобных Periptigma (Lagynana). Мы считаем (Михалевич, 1992, 1999) вероятным происхождение и других классов фораминифер также от лагинан, среди которых можно найти примитивные прототипы основных морфологических форм высших подклассов (Ammoscalarianа). Предположение о возможности происхождения роталиат от Phthanotrochus arcanus (Lagynana) (Loeblich, Tappan, 1988, pl. 10, fig. 7, 9) подкрепляется данными по их жизненным циклам и ядерному аппарату. Это единственный вид лагинан, у которого, возможно, существует ядерный дуализм (Arnold, 1978).
Оба примера лишний раз подтверждают, что первоначально складывался основной тип раковин, а затем, в процессе эволюции, происходило изменение состава и ультраструктуры раковинной стенки. В результате в классах Spirillinata, Miliolata, Nodosariata, Rotaliata почти каждому агглютинированному или микрогранулярному типу соответствует изоморфный аналог с секреционной стенкой, а низшим подклассам — высшие. В предшествующих системах такие гомеоморфные раковины рассматривались как возникшие конвергентно. Мы же рассматриваем их как родственные формы, последовательные этапы развития в каждой из этих групп, что особенно наглядно подтверждается при сравнении текстуляриан и роталиан: сходство процессов образования новых камер, морфологическое сходство в строении не только раковины, камер, устья, но и деталей строения пупочной области (Михалевич, 1972а, 1999), пупочных концов камер, величины и положения дополнительных устьев, дополнительных скелетных пластинок в пупочной области. Мало вероятно, чтобы абсолютно полное совпадение до мельчайших подробностей у таких сложных форм (пары Tiphotrocha— Neoconorbina, Arenagula—Neocribrella, Asterotrochammina — Discorbis, Dobrogelina—Sestronophora, Spiroplectinata—Euvigerina, Minouxia—Sporobulimina, Toretammina—Oridorsalis и мн. др.) могло столько раз возникать конвергентно, представляя зеркальный вариант больших групп, отличающихся друг от друга лишь составом и строением стенки. Причем совпадают не только основные структуры, но и основные тенденции их развития, стадии онтогенеза. Яркие примеры такого совпадения можно найти и у нодозариат: столь характерное только для этой группы лучистое и асимметрично-щелевидное устье возникло еще у их агглютинированных форм (Nodosinum, Cuneata). О возможности постепенного перехода от агглютинированной стенки к секреционной известковой уже говорилось выш, а также: Михалевич, 1995, 1999). Поэтому прежних текстуляриан, объединявшихся только на основании наличия у них агглютинированной стенки, мы рассматриваем как сборную группу. Из их состава мы переводим псевдодвухкамерные трубчатые раковины, клубковидные многокамерные раковины одного из милиолятных типов строения и раковины с нодозариатными типами строения в соответствующие классы — Spirillinata, Miliolata, Nodosariata в качестве их более примитивных подклассов. Выявление среди инволютных литуолид и среди атаксофрагмиид других агглютинированных представителей класса Nodosariata требует дополнительного морфологического анализа.
Выяснение за последние годы закономерностей процессов образования новых камер у представителей классов Spirillinata и Miliolata подтверждает глубокие отличия их от роталиат. В результате в подклассе Textulariana остаются только представители с роталиатными типами строения. Такой подход позволил сформулировать более четкие диагнозы и устранить значительное число параллелизмов, возникавших в прежних системах. В класс Astrorhizata вошли только примитивные однокамерные и псевдомногокамерные формы с тектиновой, агглютйнированной и микрогранулярной стенкой. Наиболее примитивным и, по- видимому, сборным является подкласс Lagynana, нуждающийся в дополнительных исследованиях. Высокоорганизованные специализированные планктонные формы входят в класс Globigerinata.
Скелет отражает план строения организма и отличается большой консервативностью. Вероятно, основные типы раковин сложились во времена кембрия— карбона, далее происходили изменения строения стенки, внутренних структур раковин, их устья. Фораминиферы представляют уникальную группу, поскольку их филогенетическая история, таксономия, распространение в прошлом имеют подробную и объективно контролируемую историческую основу. Представленная ниже система фораминифер не противоречит данным исторической геологии. Наиболее древними, но сохранившимися до наших дней являются Lagynana, Astrorhizana и Spirillinata, известные с кембрия. В ордовике появились древние Nodosariata и, по-видимому, Miliolata, потомки которых процветают и ныне. Давшие пышный расцвет в девоне и карбоне Fusulinoida со сложно устроенной массивной раковиной целиком вымерли. У них не появилось ни значительных усложнений строения устья, ни наружной скульптуры стенки. Их интегрирующие системы — туннели — более примитивные структуры по сравнению с системой каналов роталиан. Именно массивность и несовершенство микрогранулярной стенки могли стать причиной, закрывшей этой высокоразвитой группе дальнейший путь эволюционных преобразований. Агглютинированные формы роталиат (Textulariana) существуют с карбона до наших дней. С триаса стали заметны, а в мелу достигли пышного расцвета современные высшие роталиаты — подкласс Rotaliana и несколько позже, с Юры, — произошедшие от них планктонные Globigerinata. И те и другие представляют высшую ступень в развитии группы, как млекопитающие среди остальных позвоночных. Они же наиболее богато представлены в современных морях.
Место в системе протистов
Представление о протистах как о типе кардинально изменилось с развитием электронной микроскопии. Это была сборная, скорее экологическая, чем систематическая, группа. Преимущественно одноклеточные эукариотные организмы в настоящее время объединяются в группу протистов с различным числом типов (от 18 до 45) (Крылов и др., 1980; Corliss, 1984). Наметилась также тенденция к увеличению числа царств и объединению их в доминионы (Кусакин, Дроздов, 1998). Сравнение фораминифер с близкими группами прежних саркодовых (Старобо- гатов, Михалевич, 1985; Михалевич, 1999) показывает их глубокие различия. Между фораминиферами и радиоляриями больше различий (ядерный аппарат, псевдоподии, состав и форма скелета, жизненные циклы и образ жизни), чем сходства (трубчатые кристы митохондрий, двухжгутиковые гаметы и закрытый внутриядерный плевромитоз). Если сравнить ядерный аппарат фораминифер с таковым радиолярий (1 высокополиплоидное ядро) и акантарий (мно- гоядерность, по-видимому без полиплоидии), то окажется, что фораминиферы в отличие от этих групп использовали в своей эволюции не один, а оба возможных пути. Ядерный диморфизм среди протистов встречается еще только у инфузорий, но у них имеются чаще 1, а не множество Ми и иные жизненные циклы. Обычный путь эволюции генома — первоначальная полимеризация ядер, затем полимеризация геномов (полиплоидизация) и последующая олигомеризация ядер. На пути полимеризации геномов и олигомеризации ядер фораминиферы продвинуты в меньшей степени, чем инфузории. Судьба соматического ядра у них иная, чем у радиолярий и инфузорий, — оно не наследуется дочерними клетками, а разрушается и у бесполой стадии. Инфузории давно рассматриваются как тип. Сходство жгутика Boderia turneri (Lagynana) (см. раздел: «Строение гамет») со жгутиком хризомонадовых позволило рассматривать эти группы как близкие (Loeblich, 1974). Недавно жгутики с мастигонемами обнаружены еще у одного вида фораминифер из высших роталиат — у Nummulites venosus (Roettger et al., 1998). Однако сближению фораминифер с хризомонадовыми противоречит наличие у хризомонад кремнеземного скелета. Наличие у фораминифер трехжгутиковых форм и способность к откладыванию извести скорее позволяет сближать их с Haptophyta (Prymnesiomonada) (Михалевич, 1980, 1999; Старобогатов, Михалевич, 1985).Особенности ядерного аппарата фораминифер, черты его высокой специализации и большой продвинутое, а также своеобразие морфофизиологического направления эволюции скелета фораминифер, создавших новую уникальную интегрирующую структуру организменного уровня — каналы, особенности строения их гранулоретикулоподий, гамет и жгутиков, а также необычность жизненных циклов (антитетическая смена поколений с промежуточной редукцией) позволили нам поднять их ранг до подтипа (Михалевич, 1980), а затем до типа (Михалевич, 1999). Анализ последовательностей нуклеотидов ДНК у фораминифер показал их несходство со всеми другими изученными последовательностями известных групп прокариот и эукариот и подтвердил уникальность этой группы протистов (Langer et al., 1993).
Книги:
 Протисты. Руководство по зоологии. Часть 1. Алимов А.Ф. 2000
Протисты. Руководство по зоологии. Часть 1. Алимов А.Ф. 2000
 Протисты. Руководство по зоологии. Часть 2. Алимов А.Ф. 2007
Протисты. Руководство по зоологии. Часть 2. Алимов А.Ф. 2007
 Протисты. Руководство по зоологии. Часть 3. Алимов А.Ф. 2011
Протисты. Руководство по зоологии. Часть 3. Алимов А.Ф. 2011
 Жизнь животных. Том 1. Простейшие. Кишечнополостные. Черви / В. Е. Соколов - 1987
Жизнь животных. Том 1. Простейшие. Кишечнополостные. Черви / В. Е. Соколов - 1987



 Зоология беспозвоночных. Функциональные и эволюционные аспекты. В 4 томах. / Рупперт Э.Э., Фокс Р.С., Барнс Р.Д. - 2008
Зоология беспозвоночных. Функциональные и эволюционные аспекты. В 4 томах. / Рупперт Э.Э., Фокс Р.С., Барнс Р.Д. - 2008
 Вестхайде В., Ригер Р. Зоология беспозвоночных. = Spezielle Zoology. Teil 1: Einzeller und Wirbellose Tiere / пер. с нем. О. Н. Бёллинг, С. М. Ляпкова, А. В. Михеев, О. Г. Манылов, А. А. Оскольский, А. В. Филиппова, А. В. Чесунов; под ред. А. В. Чесунова. — М.: Товарищество научных изданий КМК, 2008. — С. 366—423
Вестхайде В., Ригер Р. Зоология беспозвоночных. = Spezielle Zoology. Teil 1: Einzeller und Wirbellose Tiere / пер. с нем. О. Н. Бёллинг, С. М. Ляпкова, А. В. Михеев, О. Г. Манылов, А. А. Оскольский, А. В. Филиппова, А. В. Чесунов; под ред. А. В. Чесунова. — М.: Товарищество научных изданий КМК, 2008. — С. 366—423
 Биологический энциклопедический словарь под редакцией М. С. Гилярова и др., М., изд. Советская Энциклопедия, 1989
Биологический энциклопедический словарь под редакцией М. С. Гилярова и др., М., изд. Советская Энциклопедия, 1989