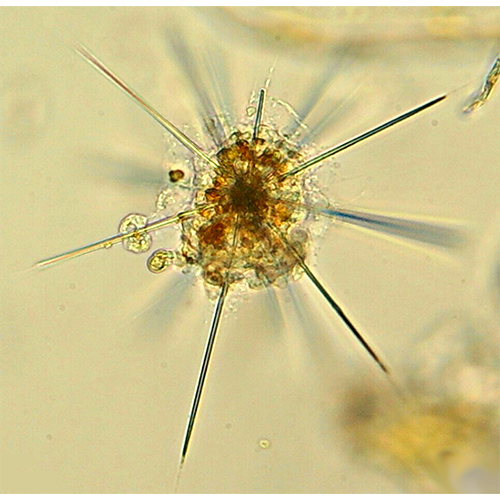
ОПИСАНИЕ:
КЛАСС АКАНТАРИИ / ACANTHARIA Muller 1855
Гетеротрофные протисты с аксоподиями, представители морского планктона. Клетка радиально симметрична. Все представители обладают внутриклеточным минеральным скелетом из сульфата стронция. Скелет включает 20 радиальных элементов, взаиморасположение которых строго упорядочено и описывается так называемым законом Мюллера. На дистальных концах спикул скелета растянут внеклеточный покров из переплетенных между собой эластичных волокон. Покров прикреплен к спикулам через сократимые фибриллы — миофриски. Центральная капсула внеклеточная. Акантарии обитают преимущественно в эпипелагиали тропических зон океанов. У большинства видов имеются внутриклеточные симбиотические микроводоросли.История изучения
Акантарии, населяющие пелагиаль океана — это крупные (до миллиметра и более) клетки с ярко окрашенной центральной зоной цитоплазмы и со светопреломляющими иглами. Они хорошо различимы в планктонных ловах при малых увеличениях оптики или даже невооруженным глазом. Поэтому акантарии стали известны еще на заре изучения морского микропланктона. Представителя акантарий (Acanthometra) впервые упомянул Мюллер (Muller, 1855).Для Эрнеста Геккеля радиолярии (в том числе акантарии) были излюбленным объектом.' Его изящные и порой преувеличенно художественные иллюстрации, представленные в частности в специальной монографии Die Radiolarien (Haeckel, 1862) и в знаменитых сборниках таблиц Kunstformen der Natur (Геккель, 2009), сделали радиолярий известными широкой публике.
Санкт-Петербургский зоолог В.Т. Шевяков, работая на Неаполитанской морской биологической станции, детально изучил фауну средиземноморских акантарий. В отличие от предшественников, в частности Геккеля, которые классифицировали акантарий исключительно по строению минерального скелета, Шевяков ввел в систематику акантарий цитологические признаки, и эта традиция сохранилась до наших дней. Публикации профессора Шевякова (Schewiakoff, 1902, 1926), иллюстрированные совершенными зоологическими рисунками, и ныне, через столетие не утратили сво- его научного значения, оставаясь самым масштабным исследованием, посвященным биологии и классификации акантарий.
Во второй половине XX века радиолярии вызывали научный интерес в первую очередь как объект палеонтологических исследований. Поскольку скелет акантарий не сохраняется в ископаемом состоянии, основное внимание уделялось полицистинам, а интерес к аканта- риям был незначителен. В этот период публикации по акантариям немногочисленны, тем не менее, выяснены детали организации скелета и изучена ультраструктура клетки. Крупный вклад внесли ученица В.А. Догеля В.В. Решетняк и группа французских исследователей, в первую очередь, Ж. и М. Кашоны и Ж. Февр (Решетняк, 1981; Cachon, Cachon, 1964; Febvre, 1990). В начале XXI века акантарии вновь привлекли к себе внимание биологов в связи с попытками прояснить с помощью молекулярных методов филогенетические связи амебоидных протистов (Nikolaev et al., 2004; Kunitomo et al., 2006; Pawlowski, Burki, 2009; Gilg et al., 2010).
Строение клетки
Все акантарии — одноклеточные организмы; колоний не образуют. Контур клетки центросимметричен; он задается минеральным скелетом, состоящим из спикул. Количество радиальных элементов — всегда двадцать. Эти спикулы радиально расходятся из геометрического центра клетки, а их взаимно расположение строго упорядочено и описывается так называемым законом Мюллера. Закон этот сформулировал Геккель (Haeckel, 1862) и назвал в честь исследователя, впервые охарактеризовавшего взаиморасположение скелетных элементов у акантарий (Muller, 1859). Легче всего представить стереометрическое расположение спикул, мысленно вписав скелет акантарий в глобус с сеткой параллелей и меридианов. На рисунке 42, А показана схема скелета, состоящего из 20 игл. Иглы организованы в пять квартетов; все иглы расходятся от геометрического центра скелета. Если совместить центр клетки с центром воображаемого глобуса, то четыре спикулы так называемого экваториального квартета расположатся в экваториальной плоскости под прямыми углами друг к другу (в виде греческого креста). Дистальные концы еще четырех игл пронижут поверхность воображаемого глобуса на уровне 28,8° северной широты (Wilcock et al., 1988). По долготе эти иглы смещены на 45° относительно экваториальных. Этот квартет носит название северного тропического. Спикулы северного полярного квартета также берут начало от центра сферы, а их дистальные концы поднимаются к 57,6° северной широты. Этот квартет вновь повернут на 45° по долготе, и, соответственно, иглы расположены строго над экваториальными. Южная полусфера зеркально симметрична северной; составляющие ее квартеты называются южный тропический и южный полярный. У одного отряда акантарий скелет состоит не из двадцати радиальных спикул, а из десяти диаметральных. Стереометрия скелета при этом полностью сохраняется: каждая пара супротивных радиальных игл замещена одной диаметральной иглой.Спикулы равновелики или почти равновелики у многих представителей Acantharia, и тогда клетка имеет форму многогранника. Нередко, однако, определенные спикулы значительно длиннее и толще остальных. В этом случае более мощные иглы называют главными, а остальные побочными. Главных спикул бывает 2,4 или 6. Если имеется одна пара главных спикул, то они лежат супротивно в составе экваториального квартета; клетка при этом веретеновидная. Если скелет включает четыре главных спикулы, то они составляют экваториальный квартет, а клетка имеет форму квадратной или ромбической пластины. Наконец, шесть главных спикул — это две противолежащие экваториальные и расположенные на том же меридиане полярные; клетка тогда приобретает форму шестиугольной пластины.
Апофизы — боковые отростки на спикулах; имеются у ряда представителей Symphyacanthida и Arthracanthida. Если отростки ветвятся, то только в плоскости перпендикулярной оси спикулы. Разросшиеся апофизы соседних спикул могут сливаться, формируя ажурную сферу, которую называют раковиной. Скелет акантарий может включать лишь одну такую сферу, и в виде исключения две — наружную и внутреннюю — у представителей рода Phractopelta. У взрослых особей ряда видов от тангентальных апофизов отрастают гарпуновидные или иглоподобные радиальные шипы. Последние служат, скорее всего, для раскрепления сети лишенных аксонемы псевдоподий.
Скелет у акантарий, также как у полицистин и фео- дарий, полностью внутриклеточный. Основной минеральный компонент спикул весьма необычен: это целестин (сульфат стронция). Каждая спикула организована как монокристалл (Wilcock et al., 1988). Эти кристаллы по форме отличаются от известных кристаллов целестина, образующихся в результате хемогенного осаждения. Целестин откладывается в матрикс спикулогенной вакуоли; в деталях процесс биоминерализации у акантарий не изучен. Скелет обтянут мембраной единой периспикульной (англ, perispicular) вакуоли. Кристаллическая решетка целестина накладывает ограничения на форму скелета акантарий. Размер скелета взрослых особей от 0,15 до 1,6 мм, чаще от 0,2 до 0,7 мм.
Кортекс (англ, periplasmic cortex) — внеклеточный эластичный покров, сплетенный из волокон неизвестного состава. У почти всех видов акантарий кортекс имеет значительную толщину (несколько микрон) и четко различим на светооптическом уровне. Этот покров, вероятнее всего, проницаем для воды, но задерживает взвешенные частицы субмикронного размера (экспериментально не подтверждено). Кортекс натянут на кончики спикул и совместно со скелетом определяет форму клетки акантарий. Он подразделен на 20 полигональных (как правило пента- и гексагональных) пластин. В центре каждой пластины имеется крупное отверстие, через которое проходит спикула. Между собой пластины кортекса соединены специальным швом. Шов растяжим в поперечном направлении и увеличивает эластичность кортекса. Этот шов по конструкции напоминает застежку-липучку. Он способен размыкаться и замыкаться, но неизвестно задействуют ли живые акан- тарии это свойство. В русскоязычной литературе отсутствует устоявшееся наименование этой структуры (англ, elastic junction). Будем использовать термин «кортикальный шов». Каждая пластина кортекса несет несколько десятков регулярно рассеянных по ее площади тонких отверстий для выхода аксоподий. Если аксоподий мало, то они все выходят на границе между пластинами — в зоне кортикального шва.
Миофриски (англ, myonemes) — сократимые тяжи или ленты, имеющие поперечную исчерчен- ность — подвешивают пластину кортекса к пронизывающей ее спикуле. Количество миоф- рисков, присоединенных к одной игле всегда четное, у разных видов составляет от 2 до 60. Миофриски состоят из свитых попарно нитей белка, принадлежащего к гетерогенному семейству тонких филаментов ( менее 5 нм, то есть тоньше, чем актиновый микрофиламент). Сокращение миофрисков АТФ-независимое и запускается изменением концентрации Са2+. Таким образом, у акантарий имеется оригинальная контрактильная система, неродственная широко представленным у эукариот актин-миозиновой и тубулин-динеиновой системам. Контрактильные системы, главным компонентом которых выступают сократимые белки из семейства тонких филаментов, обнаружены в разных группах протистов, в частности у Sticholonche (см. главу Taxopodida в этом томе). В наибольшей степени изучены такие системы у инфузорий: представители разноресничных инфузорий (например, Stentor и Spirostomum) способны моментально сжиматься, используя сеть тонких филаментов, вшитых в кортекс; белок спазмин обеспечивает мгновенное сокращение стебелька сидячих перитрих (Vorticella).
Центральная капсула (англ. capsule/-um, central capsule/-um, capsular wall) представляет собой внеклеточный волокнистый слой, по ультратонкому строению сходный с кортексом. Аксоподии и цитоплазматические тяжи проходят сквозь временные отверстия в центральной капсуле. Материал центральной капсулы как рукавом одевает каждую спикулу и, поднимаясь вдоль спикулы, подсоединятся к кортексу. Этот элемент конструкции называют «пери- спикульным конусом» (англ, perispicular cone). В.Т. Шевяков (Schewiakoff, 1926) и вслед за ним В.В. Решетняк (1981) считали, что центральная капсула первично отсутствует у примитивных акантарий и возникает в пределах группы как апоморфный признак. Позже, однако, выяснилось, что на ультрастуктурном уровне центральная капсула обнаруживается у всех изученных видов, в том числе у представителей семейства Acanthochiasmidae, считающегося самым архаичным. В последнем случае центральная капсула имеет вид ажурной сеточки (Febvre et al., 2000). У многих Arthracanthida имеется раковина, нередко в виде массивного панциря. Учитывая, что раковина — структура внутриклеточная, а центральная капсула — внеклеточная, непонятно, какова топология клеточной мембраны. Также невыяснено, облекает ли периспи- кульный конус апофизы и раковину у Arthracanthida. Функции центральной капсулы акантарий неочевидны. Акантария при раздражении втягивает под покров центральной капсулы почти всю внекапсулярную цитоплазму; толстостенная центральная капсула Arthracanthida, видимо, раскрепляет спикулы, препятствуя их угловому смещению (Решетняк, 1981), а также служит цистоподобной оболочкой в ходе множественного размножения (Febvre, 1990). На заре изучения радиолярий наличие плотного кожуха — центральной капсулы, — разделяющего внутреннюю и внешнюю зоны цитоплазмы, считалось синапоморфией таксона Radiolaria (Haeckel, 1862). Однако еще В.Т. Шевяков (Schewiakoff, 1926) подметил своеобразие центральной капсулы Acantharia и отличие ее от прочных, сложноорганизованных центральных капсул феодарий и полицистин. Авторитетные специалисты по современным радиоляриям, в частности, Андерсон (Anderson, 1983), не единожды подчеркивали, что применение по отношению к акантариям термина «центральная капсула» создает ложное впечатление о гомологии структур. Отметим, что центральная капсула у акантарий — образование внеклеточное, а у феодарий и полицистин — насколько это известно, внутриклеточное. Последние две группы согласно современным филогенетическим представлениям, базирующимся на молекулярных данных, не являются сестринскими (Pawlowski, Burki, 2009 и др.). Таким образом, центральные капсулы у представителей всех трех групп — образования негомологичные. В ходе этой ставшей достоянием прошлого дискуссии не было предложено иного приемлемого термина для обозначения волокнистого слоя, разделяющего слои цитоплазмы акантарий. Мы продолжим использовать термин «центральная капсула», помня о том, что речь идет о негомологичных структурах у Acantharia, Phaeodaria и Polycystina.
Псевдоподии акантарий — двух типов. Легкоразличимы прямые, упругие, неанастомозирующие аксоподии. Они имеются у всех акантарий; длина их составляет 100-300% радиуса цитоплазматического тела, а толщина несколько микрон. Упругость аксоподии обеспечивает аксонема — пучок микротрубочек, собранных в квазикристаллическую конструкцию. Микротрубочки аксонемы, как это характерно для ак- тинопод (радиолярий и солнечников), связаны между собой несократимыми мостиками; взаимное скольжение микротрубочек невозможно. Так называемая валентность микротрубочек — это количество мостиков, выявляемых на поперечном срезе аксонемы у одной микротрубочки. В аксонемах акантарий валентность микротрубочек составляет 2 или 3. ЦОМТы аксонем закреплены на базальных участках скелетных игл. Аксонемы радиально расходятся из центра клетки, пронизывают внутрикапсулярную цитоплазму и, обтянутые плазмалеммой, продолжаются в виде аксоподий. Количество аксонем и место, где каждая выходит за пределы цитоплазматического тела, у большинства форм характеризуются постоянством; отверстия для выхода аксоподий распределены по площади кортекса регулярно. Деполимеризация микротрубочек и втягивание аксоподий осуществляется очень быстро, за секунду. Расправление ореола аксоподий — гораздо более длительный процесс, занимающий несколько минут. При росте аксоподии происходит полимеризация микротрубочек аксонемы. По аксонемам перемещаются различные везикулы и органоиды, в частности, митохондрии и экструсомы. Механизм транспорта неизвестен; рваный ритм движения частиц (Febvre et al., 2000), возможно, указывает на то, что задействованы динеин-подобные моторные белки.
Псевдоподии второго типа не содержат аксонему. Эти нитевидные выросты клеточной поверхности ветвятся и анастомозируют, поэтому формально их следовало бы именовать ретикулоподиями. Однако современное звучание термина подразумевает, что основу цитоскелета составляют микротрубочки, а в данном случае об устройстве цитоскета ничего неизвестно. Поэтому будем использовать более широкий термин «ризоподии», тем самым подчеркивая, что эти выросты морфологически отличны от аксоподий, но пока непонятно к какому типу псевдоподий принадлежат (название «ризоподии» восходит к имени таксона Rhizopoda, который в системе Бючли объединял сарко- довых с лобо-, фило- и ретикулоподиями). Ризоподии акантарий занимают три различные позиции и, возможно, имеют различное строение.
1. От концов спикул центробежно отходит кисточка ризоподий. Такие терминальные ризоподии обильно развиты на главных спикулах. Не установлено, имеются ли они у всех акантарий и какова их функция.
2. Под кортексом у всех акантарий находятся анастомозирующие тяжи цитоплазмы. Одна функция этих субкортикальных ризоподий очевидна — они участвуют в питании.
3. Решетняк (1981) и Петрушевская (1986) приводят схему организации клетки акантарии, на которой изображены «филоподии» — тонкие анастомозирующие псевдоподии, составляющие ворсистый слой над поверхностью кортекса. Эта схема, по-видимому, адаптирована из работы Дельри и Меринфельда (Delrie, Merinfeld, 1965); первоисточник мне недоступен. Февр с соавторами (Febvre et al., 2000) описывают, видимо, ту же структуру («reticulopodial network», с. 785) как анастомозирующие тяжи цитоплазмы, которые выходят сквозь кортекс и служат для улавливания добычи; однако авторы не дают ссылок и не приводят иллюстраций. Подтверждающих микрофотографий мне не удалось найти в литературе: существует ли гало надкортикальных ризоподий — вопрос заслуживающий доисследования.
Цитоплазма акантарий подразделена на концентрические зоны. Термины для обозначения зон восходят к протозоологической концепции XIX века (Haeckel, 1862, 1887; Butschli, 1880-1889), согласно которой клетка простейших разделена на студенистую эктоплазму и разжиженную эндоплазму, причем у представителей таксона Radiolaria (куда входили акантарии, феодарии и отряды нынешних полицистин) толстая эктоплазма отграничена центральной капсулой от эндоплазмы и включает три концентрических слоя: саркоматрикс (облекающий центральную капсулу тонкий уплотненный слой, где берут начало анастомозирующие псевдоподии), калимму (толстый срединный прозрачный или пенистый слой) и саркодиктиум (наружный тонкий уплотненный слой, где синтезируется скелет). Стратификация цитоплазмы акантарий совсем не укладывается в означенную схему; ведь сегодня понятно, что планктонные актиноподы составляют по- лифилетическую группировку, и «радиолярный» план строения клетки (аксоподии, внутриклеточный минеральный скелет, центральная капсула, калимма) приобретен ими конвергентно. В простейшем случае у акантарий различимы (при малом увеличении) только две зоны. Тогда их именуют эктоплазмой и эндоплазмой. Разумеется, это лишь привычные термины; подразделение цитоплазмы на эндоплазму и эктоплазму у акантарий не гомологично таковому у других амебоидных протестов (в частности у голых амеб). У большинства видов акантарий в цитоплазме отчетливо различимы как минимум три зоны: 1) внутренняя интенсивно окрашенная; 2) промежуточная гранулярная и 3) внешняя прозрачная или пенистая. Во внутренней зоне цитоплазмы размещаются ядра, а также зерна пигмента, придающие ей желтый, красный, коричневый или почти черный цвет. Промежуточная зона лишена пигментных зерен; сюда проникают лакуны, заполненные морской водой. Центральная капсула, когда она выявлена, охватывает цитоплазму промежуточной зоны. Внешняя зона — традиционно ее называют «калиммой» — почти лишена органоидов; здесь встречаются пищеварительные вакуоли. На ультраструктурном уровне калимма представляет собой рыхлое губчатое тело, состоящее из анастомозирующих тяжей цитоплазмы, перемежающихся с цистернами. По крайней мере часть этих цистерн открыты во внешнюю среду и заполнены морской водой. Среди цистерн, вероятно, имеются вакуоли, обеспечивающие плавучесть. Архитектура взаиморасположения цитоплазматических тяжей, инвагинаций и вакуолей не реконструирована. Февр с соавторами (Febvre et al. 2000) вслед за Геккелем называют всю внутрикапсулярную цитоплазму эндоплазмой, а всю экстракапсулярную (т.е. калимму) — эктоплазмой. В этой трактовке эндоплазма оказывается поделенной на ядросодержащую окрашенную и безъядерную неокрашенную зоны. В.Т. Шевяков (Schewiakoff, 1926) и вслед за ним В.В. Решетняк (1981) называют эндоплазмой только внутреннюю пигментированную зону, а остальные две зоны относят к эктоплазме и называют их «собственно эктоплазмой» и калиммой. Эти авторы приводят ряд аргументов в пользу такого варианта разграничения; в частности, они указывают, что тяжи цитоплазмы в составе калиммы и аксоподии выходят сквозь отверстия во внеклеточной центральной капсуле и при раздражении втягиваются под нее, сливаясь с цитоплазмой промежуточной зоны. Раковина служит дополнительной разграничительной поверхностью, и у видов с раковиной нередко различимы четыре зоны цитоплазмы. Так, у Haliommatidium имеются зоны: пигментированная, внутрираковинная гранулярная, внераковинная гранулярная и калимма. Февр (Febvre, 1990) именует эндоплазмой Haliommatidium всю внутрираковинную цитоплазму, то есть использует схему разделения, отличную от двух предыдущих. Таким образом, термины «внутрикапсулярная цитоплазма» и «внекапсулярная цитоплазма» четко определены, поскольку позиция центральной капсулы почти всегда известна; границы калиммы воспринимаются одинаково всеми авторами; относительно границы между эндо- и эктоплазмой имеются разночтения, и положение этой границы должно быть оговорено в каждом конкретном случае. Во всех иллюстрациях к этой главе эндоплазма и эктоплазма разграничены согласно Шевякову. За термином «калимма» мы предлагаем оставить лишь его описательный смысл, отняв какую-либо таксономическую привязку: светлый пенистый слой цитоплазмы, облекающий клетку крупных пелагических амебоидных протестов (радиолярий в широком смысле и фора- минифер) или крупных солнечников. Помимо концентрических компартментов существует и радиальный: между спикулой и одевающей ее рукавом материала центральной капсулы залегает цитоплазма, которая характеризуется отсутствием ядер и пигмента, прозрачностью, высокой интенсивностью цитоплазматических токов. В русскоязычной литературе нет термина для обозначения этой зоны; будем использовать кальку английского названия — «периспикульная цитоплазма» (perispicular cytoplasm). Саркоматрикса и саркодиктиу- ма в понимании ранних авторов у акантарий нет. Наружным уплотненным слоем — саркодиктиумом — называли кортекс, исходя из ошибочного допущения, что он является структурой внутриклеточной. Этот термин (саркодиктиум), чтобы не создавать нового, можно использовать для обозначения цитоплазмы, которая обволакивает спикулы и отростки спикул.
Органоиды акантарий — обычные для эукариотной клетки, в том числе имеются многочисленные мелкие митохондрии с трубчатыми кристами. Липидные глобулы обильны во внутрикапсулярной цитоплазме.
Литосомы — овальные пластинки с двойным лучепреломлением, по всей вероятности, с сернокислым стронцием в качестве минерального компонента. Они синтезируются в аппарате Гольджи и накапливаются во внутрикапсулярной цитоплазме перед инци- стированием у Holacanthida, Symphyacanthida и Chaun- acanthida. Позже они транспортируются к плазмалемме и встраиваются в цистную оболочку. Обозначенные на рисунках Шевякова кристаллоиды, видимо, являются литосомами. Иной природы кристаллические тела в мембранной упаковке — светопреломляющие, но без двойного лучепреломления — известны у молодых особой Holacanthida (Febvre, 1990).
Экструсомы акантарий в состоянии покоя имеют электронноплотный аксиальный элемент (Febvre, 1990), и, таким образом, морфологически сходны к кинетоцистами, которые изучены у центрохелидных солнечников (Acanthocystis, Raphidiophrys) и десмото- рацидных солнечников (Clathrulina') (Sakaguchi et al., 2002). Синтез предшественников идет в комплексе Гольджи во внутрикапсуллярной цитоплазме. Зрелые экстру сомы, располагаются не только на аксоподиях, но и в тяжах эктоплазмы. Очевидно, экструсомы задействованы в улавливании и иммобилизации добычи. Механизм экструзии не известен.
Ядра у взрослых трофонтов множественные, присутствуют в эндоплазме в количестве десятков штук. Исключение составляют представители рода Haliommatidium (отряд Symphyacanthida), чьи зрелые трофон- ты обладают единственным крупным, полиплоидным ядром (Febvre, 1990). С. Февр с соавторами (Febvre et al., 2000) сообщают, что и другие представители семейства Pseudolithidae имеют единственное полиплоидное ядро, однако, Шевяков иллюстрирует множественные ядра для Dicranophora; мне не удалось понять, в чем причина разночтений. Оболочка крупного одиночного ядра Haliommatidium подостлана ламиной — матом переплетенных фибрилл. У многоядерных акантарий ядра изоморфные, мелкие (порядка 10 мкм в диаметре), округлые. Плоидность их не установлена. У других одноклеточных организмов с множественными мелкими ядрами, такие ядра имеет плоидность 1 или 2; диплоидны, в частности, ядра опалин (Райков, 1978). Деление ядер акантарий протекает по типу закрытого плевромитоза с внутриядерным веретеном. ЦОМТы полуверетен встроены в поры ядерной оболочки. В цитозоле вблизи каждого ЦОМТа происходит сборка пары центриолей (Febvre, 1990). Мейоз неизвестен, синаптонемальные комплексы не описаны.
Фотосимбионты имеются почти у всех акантарий. Для большинства видов фотосимбионтами выступают гаптофиты. Известны две морфы: безжгутиковая и трехжгутиковая; обе морфы могут присутствовать одновременно в клетке хозяина. Ряд видов отряда Chaun- acanthida состоит в сожительстве с динофлагеллатами (Febvre, 1990). Оба типа окрашенных симбионтов принадлежат к филетической линии Chromista; таких принято называть зооксантеллами. Зооксантеллы локализуются во внутренних зонах цитоплазмы и очень редко в калимме. Клетки фотосимбионтов нередко становятся основным по объему компонентом содержимого центральной капсулы. Перед инцистированием или размножением хозяин переваривает или выбрасывает зооксантелл. Ювенильные особи лишены фотосимбионтов и получают их из внешней среды. По мере роста трофонта концентрация зооксантелл в эндоплазме нарастает. Не выяснено, насколько специфичны отношения фотосимбионта и хозяина.
Физиология и питание
Флотирование акантарий охарактеризовано на феноменологическом уровне. В.Т. Шевяков (Schewiakoff, 1926) отмечал, что у экземпляров, всплывающих к самой поверхности воды после дней затишья, кортекс полностью вздут (Решетняк, 1981). Клетка акантарий может незначительно изменять свою форму за счет работы миофрисков. Каждый миофриск обладает способностью сокращаться независимо от других, но чаще происходит координированное сокращение всего ансамбля (Febvre, 1990). У недавно пойманных живых экземпляров, временно содержащихся в аквариуме, резкое сокращение всех миофрисков наблюдается каждые 10-20 минут, причем эта активность как-то сопряжена со способностью акантарий удерживать плавучесть близкую к нулевой (Febvre et al., 2000). В результате сокращения миофрисков каждая пластина кортекса оказывается подтянутой к вершине спикулы, весь кортекс натягивается на окончаниях спикул, эластичный кортикальный шов претерпевает поперечное растяжение.Устройство гидростатического аппарата акантарий и механизм его работы, как ни странно, не охарактеризованы; имеющиеся в литературе версии не учитывают действия простых физических законов. Рассуждения об ажурности раковины (Петрушевская, 1986 и др.) никак не проясняют вопрос, почему клетка остается наплаву: ведь минеральный скелет — неважно ажурный или массивный — будет иметь плотность как минимум в два раза превышающую плотность воды, и должен существовать компенсаторный механизм. Корона аксоподий обеспечивает сопротивление формы и, разумеется, замедляет опускание по закону Стокса, но не может остановить это опускание. Считается, что при сокращении миофрисков пространство под кортексом увеличивается, в лакуны калиммы насасывается дополнительный объем морской воды, и клетка всплывает (Решетняк, 1981). Это объяснение тоже нереалистично: переменный объем морской воды в лакунах калиммы не изменит знак плавучести клетки (представьте дырявый волейбольный мяч, заполненный водой; его плавучесть не будет сколько-нибудь заметно зависеть от того, расправлен ли он или слегка сжат). Для того чтобы клетка — особенно клетка с тяжелым скелетом — сохраняла нейтральную плавучесть, она должна обладать отделами с содержимым меньшей плотности, чем морская вода. Таким поплавком, вероятно, выступают липидные глобулы, в обилии содержащиеся у всех акантарий во внутрикапсулярной цитоплазме. Однако, согласно натурным наблюдениям, акантарий способны быстро уходить на глубину. Оперативно уменьшить подъемную силу жирового поплавка вряд ли возможно: сжигание жира — долговременный процесс; альтернативно, клетка могла бы извергнуть липидные включения, но подобный процесс, по-видимому, не описан ни для каких протистов. Следовательно, акантарий дополнительно обладают водным поплавком — вакуолями с водой, где тяжелые ионы частично замещены легкими (см. раздел Плавучесть в главе Phaeodaria в этом томе). Для того чтобы вода осмотически нагнеталась в вакуоли, они должны быть отграничены от внешней среды слоем цитоплазмы минимальной толщины, и, значит, эти вакуоли располагаются, скорее всего, в калимме. Косвенным подтверждением тому служит название самой длинной спикулы у Amphilithium. Помимо «задней» ее еще называют «нижней» (Решетняк, 1981). То есть ранние авторы, ведя прижизненные наблюдения, отметили, что эта спикула вместе с надетым на нее массивом эндоплазмы обращена вниз. Следовательно, поплавок расположен в противолежащем компартменте — калимме. Поведенческие реакции, описанные в начале раздела, можно интерпретировать следующим образом. У клеток, всплывших к поверхности океана, кортекс вздут под воздействием набухших вакуолей калиммы. Сокращение миофрисков опосредованное радиальным смещением кортекса нагнетает в лакуны калиммы свежую порцию морской воды, которая замещает рассол, отжатый при осмотическом транспорте Н2О в вакуоли. В ответ на любое раздражение клетка отвечает неспецифической реакцией бегства: вакуоли схлопываются (кортекс поэтому опадает), и акантария погружается.
Акантарий обитают у самой поверхности океана (см. раздел Экология) и, видимо, обладают самым совершенным гидростатическим аппаратом среди всех планктонных протистов (Решетняк, 1981). Примечательно, что акантарий — эти совершенные плактеры — имеют минеральный скелет большей плотности (целестин 4,0 г см-3), нежели любые другие организмы, в том числе бентосные и наземные2. Надо полагать, наличие минерального скелета у всех планктонных амебоидных протистов — это конвергентно возникшая адаптация к планктонному образу жизни. Тяжелый балласт в составе гидростатического аппарата позволяет за счет схлопывания вакуолей калиммы быстро погружаться, уходя от опасности.
Пищевой спектр акантарий широк. Микроскопирование пищевых вакуолей показало, что в состав жертв из микропланктона входят тинтинниды и другие инфузории, диатомовые, динофлагеллаты, веслоногие рачки от науплиуса до взрослых, а также пелагические моллюски и пелагические саркодовые (Caron, Swanberg, 1990). Применение эпифлюоресцентной микроскопии показало наличие в пищевых вакуолях окрашенного наннопланктона и даже мелких (пикопланктонных, менее 2 мкм) цианобактерий; кроме того обнаружены и гетеротрофные бактерии (Febvre et al., 2000). Неясно, захватывают ли акантарий мелкую пищу целенаправленно или попутно с более крупными объектами. Количественные оценки питания отсутствуют; упоминаются наблюдения, что перевариваемые организмы в пищевых вакуолях наблюдаются весьма редко (Febvre, 1990).
Последовательность событий при захвате пищевых объектов, в том числе крупных, прослежена не полностью. На аксоподиях имеются экструсомы; нет наблюдений, свидетельствующих, что эти экструсомы заяко- ривают или обездвиживают добычу. Альтернативный или дополнительный аппарат пищедобычи — это гало ризоподий, выставленных сквозь кортекс (Febvre et al., 2000), однако само существование этого гало сомнительно (см. раздел Строение клетки). Каким образом жертва транспортируется под кортекс неизвестно; гипотетически, может размыкаться кортикальный шов, но свидетельства тому отсутствуют. Часть экструсом располагается в тяжах цитоплазмы под кортексом (Febvre, 1990), где они, очевидно, задействованы в процессе пищедобычи. Пищеварительные вакуоли размещены только во внекапсулярной цитоплазме, здесь же отмечены лизосомы (Febvre, 1990). Дефекационные вакуоли смещаются к периферии калиммы и затем как-то выводятся за пределы кортекса (Schewiakoff, 1926, цит. по: Решетняк, 1981). Пигментные гранулы, возможно, представляют собой накапливаемые непереваренные остатки.
Зооксантеллы обнаружены почти у всех видов акантарий, причем имеются в большом количестве у взрослых трофонтов. Соответственно, предполагается, что фотосимбионты играют важную роль в трофике акантарий, но измерения потоков азота, фосфора и сахаров между симбионтом и хозяином не выполнялись. Темп размножения зооксантелл низок по сравнению с расчетным; это позволяет предполагать, что акантария забирает значительную долю продукции фотосимбионтов (Febvre et al., 2000).
Размножение и жизненные циклы
Акантарий не удается поддерживать в культуре. Экземпляры, собранные в море, выживают в лаборатории лишь в течение нескольких часов, максимум двух недель, при этом удерживая себя во взвешенном состоянии. Затем клетки оседают на дно и лизируются; иногда перед гибелью они высвобождают сотни или тысячи подвижных жгутиконосцев, которые осаждаются на дно аквариума и погибают (Febvre, 1990; Febvre et al., 2000). Итак, непонятно даже являются ли жгутиковые клетки зооспорами или гаметами. Правда, В.Т. Шевяков (Schewiakoff, 1926) описывал слияние жгутиковых клеток и формирование амебоидных зигот, ползающих по дну аквариума. Последователям не удалось воспроизвести этот результат. Другим источником информации служат планктонные сборы, где обнаруживаются различные возрастные стадии акантарий. Понятно, что информация недостаточна, и представления о жизненном цикле акантарий фрагментарны.Примитивные акантарий Acanthachiasmidae способны делиться бинарно; судьба кортекса и миофри- сков (тонких и малозаметных) не прослежена; скелет потомки наследуют пополам и недостающие иглы достраивают (Решетняк, 1981; Febvre, 1990; Febvre et al., 2000). Подавляющее большинство акантарий неспособно к бинарному делению. Видимо, сложная архитектура клетки делает неоправданными частые масштабные перестройки в ходе каждого из следующих один за другим клеточных циклов. Акантарий реализуют альтернативную стратегию: клетка в ходе длительного периода роста накапливает пластический материал, а потом претерпевает множественное деление.
Ювенильная особь одноядерна. В.Т. Шевяков (Schewiakoff, 1926, цит. по: Решетняк, 1981) описывает зачаток целестинового скелета как звездообразное 20-лучевое образование в центре ядра; затем спикулы растут, и единственное пока ядро сохраняет центральную позицию и оказывается надетым на спикулы. Крупное одиночное ядро у зрелых трофонтов актино- под, действительно, зачастую пронизано каналами, через которые проходят балки скелета и аксонемы; таковы, например, полиплоидные ядра многих Spumellaria (Anderson, 1983). Ситуация же, когда молодое мелкого размера гаплоидное или диплоидное ядро пронизано каналами, экстраординарна. Авторы более поздних сводок не упоминают это наблюдение Шевякова, по- видимому, потому, что оно кажется сомнительным (Febvre, 1990; Febvre et al., 2000 и др.). Тем не менее, в отличие от Геккеля, Шевяков изображал только то, что видел, и хотя сегодня мы не можем объяснить, какова конфигурация ядерной оболочки ювенильной особи, надо считать, что картина, описываемая Шевяковым на светооптическом уровне, реально существует.
По мере увеличения объема клетки количество ядер нарастает (их плоидность неизвестна). Формируется многоядерный трофонт. На определенной стадии онтогенеза формируется специфичная для акантарий картина: ядра выстраиваются в концентрический монослой.
После периода питания и роста особь готовится к размножению. Эту стадию называют гамонтом, следуя терминологии Шевякова, который считал последующий процесс гаметогенезом. Гамонт разбирает кортекс, отбрасывает миофриски, выталкивает зерна пигмента и литосомы, освобождается от пищеварительных вакуолей, переваривает либо изгоняет фотосимбионтов. Эндоплазма становится прозрачной и объем ее увеличивается. Темп кариокинезов резко возрастает: ядра делятся непрерывно, их количество достигает нескольких сотен или тысяч. Происходит цитокинез: вокруг каждого ядра обособляется довольно крупный участок цитоплазмы. От центриолей отрастают два жгутика (детали строения жгутикового аппарата неизвестны). Сформировавшиеся жгутиконосцы роятся в полости центральной капсулы; о наличии или отсутствии остаточного тела нет информации. Жгутиконосные клетки всегда содержат липидные капли и, по наблюдениям В.Т. Шевякова (Schewiakoff, 1926), редко некоторые из них несут «споры зооксантелл». Как уже сказано, судьба жгутиконосных клеток не прослежена и непонятно, являются ли они зооспорами или гаметами. И, соответственно, неясно является ли весь процесс формирования жгутиковых клеток гаметогенезом или множественным бесполым размножением.
Принципиальный смысловой компонент в схеме жизненного цикла акантарий, составленной Жаном Февром (Febvre, 1990) — это вопросительный знак. Если придерживаться трактовки стадий по В.Т. Шевякову и при этом замкнуть схему цикла без знака вопроса, как это сделано в рамках последней масштабной попытки дать полную классификацию протистов (Adi et al., 2005), то придется утверждать, что акантарии размножаются исключительно половым путем. Сейчас известна единственная группа эукариот с нетканевой организацией, у которой жизненный цикл протекает без фазы агамного размножения — это споровики Eugregarinida.
Описанным путем происходит гаметогенез у Arthracanthida, которые обладают толстостенной центральной капсулой и используют ее в качестве цистной оболочки. Реализация цикла у представителей остальных отрядов отлична тем, что гамонт разбирает свою нежную центральную капсулу и строит цистную оболочку de novo из предварительно синтезированных литосом. В ходе инцистирования происходит частичная или полная разборка скелета. Соединение спикул в центре клетки разрушается, и они начинают медленно менять свою ориентацию. У формирующихся цист Chaunacanthida совокупность радиальных спикул складывается зонтиком; эту характерную стадию называют litholophus. Э. Геккель (Haeckel, 1887) описал род Litholophus с коническим пучком спикул, но позднее выяснилось, что это стадия инцистирования разных родов Chaunacanthida. Спикулы растворяются в определенных участках и разламываются на балки, которые при участии аксоподий транспортируются центростремительно; эти балки, иногда компактно уложенные параллельно друг другу, сохраняются внутри цисты. В цисте происходит множественное деление ядер. По завершении последнего деления происходит цитокинез, от центриолей отрастают ундулиподии, и формируются жгутиковые клетки.
Своеобразно протекает инцистирование у Haliommatidium (отряд Symphyacanthida). Представители этого рода обладают решетчатой раковиной, которая в отличие от раковин Arthracanthida расположена внутри центральной капсулы. При инцистировании разбираются центральная капсула и спикулы, а решетчатые пластины, из которых состоит раковина, становятся стенкой цисты. В единственном ядре наблюдаются многочисленные веретена эндомитозов. Ядро быстро разбирается на многочисленные мелкие ядра. Цитоплазма фрагментируется, и после серии преобразований формируются двужгутиковые клетки. Последние оседали на дно контейнера и в течение нескольких минут погибали (Febvre, 1990).
Неизвестно, существует ли стадия покоя, то есть неясно, являются ли цисты акантарий лишь цистами размножения, или они также обеспечивают и переживание неблагоприятных периодов (то есть выступают и как цисты покоя). Цисты акантарий обладают довольно большим удельным весом и быстро тонут (-0,5 км день1; Martin et al., 2010). Приспособительное значение этого неочевидно, учитывая, что акантарий в большинстве своем населяют удаленные от побережий поверхностные воды над океаническими впадинами. Согласно одной из гипотез, продукция цист в момент цветения фитопланктона и погружение их в батипела- гиаль обеспечивает ювенилям обильный пищевой ресурс в виде фитодетрита, оседающего после цветения (Martin et al., 2010). С другой стороны, возможно, акантарии (как и все радиолярии и планктонные форамини- феры) высвобождают жгутиконосную стадию цикла на глубине не менее 200 м, потому что ювенильные особи, как и все микронного размера планктонные организмы, не способны противостоять турбулентному перемешиванию водной толщи и легко могут быть вынесены в поверхностные воды, где повреждены штормовым волнением и слишком ярким солнцем. По мере роста и увеличения способности контролировать плавучесть (и при необходимости уходить на глубину), они поднимаются ближе к поверхности океана.
Филогения
Радиолярии — морские пелагические амебоидные протесты с аксоподиями и внутриклеточным минеральным скелетом. Приблизительно до середины XX столетия Radiolaria воспринимались как таксон. В него включали акантарий, феодарий и отряды полицистин, а также иногда Taxopodida. Однако еще В.Т. Шевяков отмечал своеобразие акантарий: 1) скелет, построенный из целестина и состоящий из радиальных, а не концентрических элементов, 2) отсутствие типичной центральной капсулы, 3) многоядерность, 4) кортекс и миофриски. Так что со временем акантарий стали выводить за пределы Radiolaria и рассматривать в качестве сестринского таксона равного ранга. Этой концепции, в частности, придерживались P.O. Андерсон (Anderson, 1983) и В.В. Решетняк (1981). Примечательно, что полицистины, приступая к множественному делению, синтезируют кристаллы сернокислого стронция, которые в итоге окажутся в цитоплазме жгутиковых клеток. Андерсон считал, что наличие SrSO4 у акантарий и полицистин говорит о древней филогенетической связи между Acantharia и Euradiolaria (Anderson, 1983), а для В.А. Догеля (1950) этот факт служил указанием на прямое родство Acantharia и Polycystina.Изучение ультраструктуры аксоподий солнечников и радиолярий выявило поразительно единообразную картину квазикристаллической упаковки микротрубочек в аксонеме (Cachon, Cachon, 1982). На основании этого сходства было предложено объединить всех амебоидных протистов с аксоподиями в таксон Actinopoda. Сюда вошли Spumellaria, Nassellaria, Phaeodaria, Acantharia, Taxopodida и все солнечники единым классом Heliozoa1. К концу XX века в концепциях царств эукариот возобладала тенденция к дроблению макротаксонов протистов и повышению их рангов. И Actinopoda, и Radiolaria, и Heliozoa воспринимались как полифи- летические группы, представители которых занимают сходные экологические ниши и конвергентно приобрели сходные черты строения, в том числе аксоподий (Febvre et al., 2000 и др.).
Впрочем, в последние годы эта полемика сошла на нет в виду решительных успехов, достигнутых молекулярными биологами. Позиция акантарий и других групп актинопод на филогенетических деревьях принципиально не меняется уже 5-6 лет (Nikolaev et al. 2004; Kunitomo et al. 2006; Pawlowski, Burki 2009; Gilg et al. 2010) и поэтому вряд ли в обозримом будущем стоит ожидать кардинального пересмотра этих воззрений. Хотя, конечно, будут еще производиться уточнения, ведь накопление данных, в первую очередь данных по нуклеотидным последовательностям гена малой субъединицы рибосомальной РНК, идет грандиозными темпами. Итак, вырисовывается следующая картина филогенетических связей радиолярий. Все отряды полицистин действительно родственны. Acantharia и Taxopodida происходят от Polycystina; и сами полицистины, таким образом, парафилетичны. Феодарии же, хоть и принадлежат тому же кластеру Rhizaria, не являются сестринской группой по отношению к полицистинам и акантариям, а входят в центральную группировку ризарий — Сег- cozoa (если надо обозначить ранги, то Rhizaria можно назвать царством, a Cercozoa подцарством). Эта схема, с одной стороны, не подтверждает ни одну из ранее существовавших концепций филогении радиолярий, а с другой неожиданно показывает, что группы радиолярий не так далеки друг от друга, как еще недавно казалось. Феодарии, которые во всех системах позиционировались как близкие родственники полицистин, таковыми не оказались, а вот акантарий, которым, исходя из перечисленных выше морфологических соображений, в родстве с полицистинами в последние годы было категорически отказано, все-таки оказались их ближайшими родственниками.
Хотя акантарий в воде порой многочисленны, количество видов акантарий невелико (около 150), причем во многих родах насчитывается 1-5 видов (Решетняк, 1981). Такая ситуация, вероятно, говорит в пользу того, что таксон давно не испытывал вспышек адаптивной радиации.
Морская вода сильно недонасыщена по сульфату стронция, поэтому скелеты отмерших акантарий растворяются по большей части еще не достигнув дна, хотя тонут они весьма быстро (Martin et al., 2010). Соответственно, палеонтологическая летопись акантарий отсутствует.
Экология
Акантарий — обитатели океанической пелагиали; существуют ли неретические виды неизвестно. В начале XX века был описан один бентосный вид с целестановыми спикулами (Podactinelius sessilis Schroder 1907), принадлежность которого к Acantharia остается недоказанной (Решетняк, 1981). Акантарий распространены циркумтропически, в высокие широты проникают лишь единичные виды, не встречаются в рас- пресненных районах, избегают вод с обильной взвесью (Решетняк, 1981; Caron, Swanberg, 1990; Febvre et al., 2000). Максимальную численность и видовое разнообразие акантарий отмечают в самом поверхностном слое пелагиали — менее 100 м.Удаленные от побережий воды субтропических круговоротов всех океанов на подавляющей части своей акватории олиготрофны. Конкуренция за ресурсы чрезвычайно напряженна и многие виды акантарий, подобно другим пелагическим протистам и разным многоклеточным планктонным и бентосным животным, вступают в симбиотические отношения с микроводорослями.
Зооксантеллы локализованы ближе к центру клетки, что отличает акантарий от остальных пелагических симбионтсодержащих амебоидных протистов (полицистин и фораминифер), которые широко распределяют своих фотосимбионтов по внешнему вакуолизированному слою цитоплазмы, по выступающим шипам скелета и по расправленным псевдоподиям. Эта особенность акантарий, вероятно, обусловлена тем, что они обитают у самой поверхности, где свет обилен и нет необходимости распределять симбионтов так, чтобы создать им оптимальные условия освещения. Косвенное подтверждение такого объяснения дают те немногие виды акантарий, которые населяют подповерхностные горизонты с малой освещенностью. У этих форм зооксантеллы рассеяны в калимме (Решетняк, 1981). Первичная продукция зооксантелл в расчете на особь хозяина у акантарий мала в сравнении с полицистинами и планктонными фораминиферами (Caron et al., 1995). Возможно, низкая продуктивность зооксантелл акантарий — это эффект их компактной упаковки в ограниченном объеме внутрикапсуллярной цитоплазмы.
Насыщающая плотность потока излучения для фотосимбионтов акантарий исключительно высока, и они продолжают фиксировать углерод даже в полдень у поверхности (Caron et al., 1995). В этом контексте, возможно, стоит вспомнить о наличии многочисленных пигментных гранул в эндоплазме акантарий и провести аналогию с протистами, живущими при избыточном освещении, такими как Chlamydomonas nivalis (Chlo- rophyta), у которого обильные каротиноиды защищают фотосистему, исполняя функцию и экрана, и антиоксиданта.
Повреждающим фактором для организма, обитающего у поверхности воды, является и штормовая тур- буленция. Считается, что акантарий обладают самым совершенным гидростатическим аппаратом среди всех пелагических саркодовых, который позволяет им концентрироваться у поверхности, но быстро уходить на глубину в преддверии надвигающегося шторма (погружение осуществляется гораздо быстрее, чем всплытие). Через несколько дней, как заштилеет, взрослые трофонты вновь скапливаются у самой поверхности.
Готовящиеся к размножению экземпляры перестают питаться и уходят на глубину 100-200 и более метров. Здесь же происходит и цистообразование. Цисты продолжают опускаться. Ювенильные особи появляются в глубинных горизонтах. С ростом они поднимаются в эпипелагиаль.
По сезонной динамике акантарий данные отрывочны.
Эксперименты с седиментационными ловушками, установленными в океане, дали весьма неожиданные результаты. Оказалось, что в батипелагиали на долю цист и мертвых клеток акантарий приходится до 5-10% потока органического вещества — это очень существенная доля, учитывая, что биомасса акантарий в поверхностных водах редко достигает 1% суммарного обилия автотрофных и гетеротрофных планктеров. Интенсивная продукция цист, а также большой удельный вес цист и скелетов акантарий за счет целестина и, как следствие, высокая скорость их оседания, по- видимому, обуславливают этот дисбаланс (Michaels et al., 1995; Martin et al., 2010). Секвенирование ДНК из проб морской воды с глубины несколько километров выявило разнообразные последовательности, принадлежащие акантариям (или неизвестным родственникам акантарий) (Not et al., 2007; Alexander et al., 2009). Таким образом, акантарий вносят существенный, не вполне еще оцененный вклад в поток органических и минеральных частиц на дно океана.
Стронций служит индикатором определенных событий, происходивших в океане в прошлом. Палеоокеанологи изучили современное распределение Sr в океанах, и оказалось, что верхний стометровый слой водного столба обеднен стронцием по сравнению с нижезалегающей толщей. Планктонологические исследования показали, что именно поток тонущих цист и скелетов акантарий выносит сернокислый стронций из эпипелагиали (De Deckker, 2004; Martin et al., 2010). Загадкой долго оставалось происхождение обильных микрочастиц барита, взвешенных в толще вод океана, пока не обнаружили, что растворение целестина в морской воде сопряжено с выпадением в осадок BaSO4 (Bernstein, Byrne, 2004). Помимо того, барий в заметных количествах присутствует в качестве примеси в целестине акантарий и, также как стронций, транспортируется в глубинные воды потоком их цист и скелетов. Таким образом, цикл Sr и Ва в океане в значительной мере находится под контролем протистов акантарий.
Питание, метаболизм, клеточные компартменты, ядерные фазы, жизненный цикл, поведение, адаптации акантарий совсем или почти совсем не изучены. Эти изящные морские протисты безусловно заслуживают более пристального внимания.
Книги:
 Протисты. Руководство по зоологии. Часть 1. Алимов А.Ф. 2000
Протисты. Руководство по зоологии. Часть 1. Алимов А.Ф. 2000
 Протисты. Руководство по зоологии. Часть 2. Алимов А.Ф. 2007
Протисты. Руководство по зоологии. Часть 2. Алимов А.Ф. 2007
 Протисты. Руководство по зоологии. Часть 3. Алимов А.Ф. 2011
Протисты. Руководство по зоологии. Часть 3. Алимов А.Ф. 2011
 Жизнь животных. Том 1. Простейшие. Кишечнополостные. Черви / В. Е. Соколов - 1987
Жизнь животных. Том 1. Простейшие. Кишечнополостные. Черви / В. Е. Соколов - 1987



 Зоология беспозвоночных. Функциональные и эволюционные аспекты. В 4 томах. / Рупперт Э.Э., Фокс Р.С., Барнс Р.Д. - 2008
Зоология беспозвоночных. Функциональные и эволюционные аспекты. В 4 томах. / Рупперт Э.Э., Фокс Р.С., Барнс Р.Д. - 2008
 Вестхайде В., Ригер Р. Зоология беспозвоночных. = Spezielle Zoology. Teil 1: Einzeller und Wirbellose Tiere / пер. с нем. О. Н. Бёллинг, С. М. Ляпкова, А. В. Михеев, О. Г. Манылов, А. А. Оскольский, А. В. Филиппова, А. В. Чесунов; под ред. А. В. Чесунова. — М.: Товарищество научных изданий КМК, 2008. — С. 366—423
Вестхайде В., Ригер Р. Зоология беспозвоночных. = Spezielle Zoology. Teil 1: Einzeller und Wirbellose Tiere / пер. с нем. О. Н. Бёллинг, С. М. Ляпкова, А. В. Михеев, О. Г. Манылов, А. А. Оскольский, А. В. Филиппова, А. В. Чесунов; под ред. А. В. Чесунова. — М.: Товарищество научных изданий КМК, 2008. — С. 366—423
 Биологический энциклопедический словарь под редакцией М. С. Гилярова и др., М., изд. Советская Энциклопедия, 1989
Биологический энциклопедический словарь под редакцией М. С. Гилярова и др., М., изд. Советская Энциклопедия, 1989